Укажите металл атом которого входит в состав молекулы гемоглобина
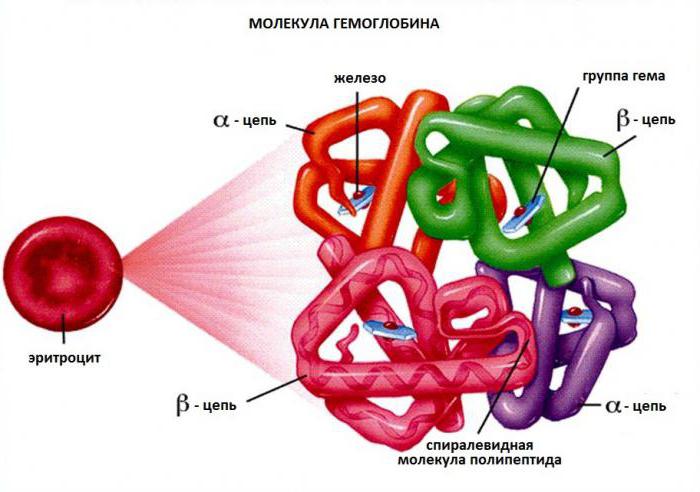
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & C Chothia (1976), “Structural patterns in globular proteins”, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Какой микроэлемент входит в состав гемоглобина и эритроцитов? Кровь является самой важной субстанцией организма человека. Она обеспечивает питание, а кроме того, межклеточный обмен.
Гемоглобин представляет собой вещество белковой природы, которое входит в состав кровяных телец, которые отвечают за так называемую транспортировку кислорода между клетками различных органов человека и легкими. В том случае, если гемоглобин в крови человека понижен, то кислород к тканям поступает весьма слабо.
Нарушение столь важного процесса может очень плохо отразиться на общем самочувствии человека. Но также негативно на здоровье сказывается и его повышенный уровень.
Элемент, входящий в состав гемоглобина, интересует многих.
Отклонения содержания гемоглобина в крови
Дефицит данного вещества способен вызывать упадок сил наряду с общей слабостью организма, снижением трудоспособности и нарушением памяти. В качестве сопутствующих симптомов человек может наблюдать у себя частые обморочные состояния либо следующие признаки:
- Высыхание слизистых.
- Высыхание кожных покровов.
- Ослабление ногтей и волос.
Ионы железа
Ионы железа, которые входят в состав гемоглобина, занимаются доставкой кислорода к клеткам всех тканей. Поэтому нехватка данных элементов вызывает так называемую железодефицитную анемию.
Подобные патологические состояния способны вызвать у людей не только снижение уровня железа в гемоглобине. Вероятна обильная потеря этого элемента во время месячных, в процессе родов. Основным источником этого элемента в продуктах выступает животный белок. Собственно, его недостаток и вызывает плохое самочувствие.
Что касается высокого показателя гемоглобина, то это свидетельствует о повышенном уровне сахара, об онкологических процессах либо всевозможных нарушениях работы сердца и так далее. О данном состоянии может свидетельствовать и дефицит фолиевой кислоты, витамина В12. При повышенных показателях гемоглобина кровь обладает высокой вязкостью и густой консистенцией. Такое явление может послужить причиной образования тромбов в сосудах, что гарантированно приводит к инфарктам.
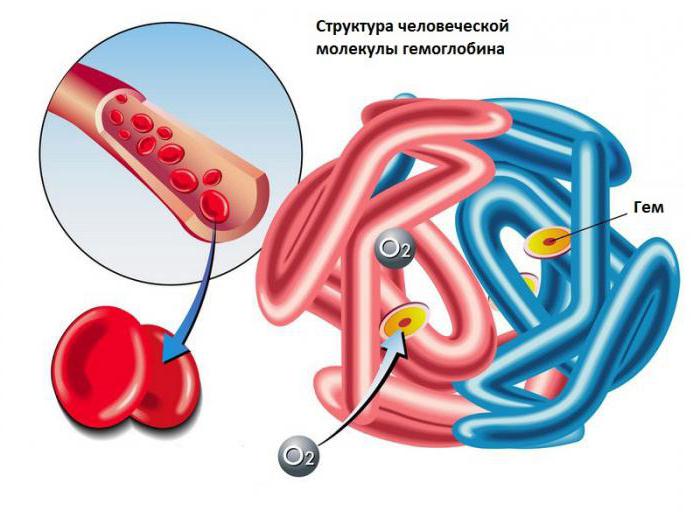
Таким образом, показатель гемоглобина в составе крови обязательно должен находиться в норме. Для того чтобы предупредить столь опасные патологии в организме, как анемия, доктора всегда назначают сдачу крови на гемоглобин.
О чем говорит анализ крови?
Без выполнения общего анализа крови нельзя произвести ни одного диагностирования. Расшифровка составляющих компонентов имеет несколько этапов, позволяющих определить степень опасности заболевания, динамику его развития в рамках проведенного лечения.
Главным в анализе служит значение наличия эритроцитов наряду с лейкоцитами, уровнем гемоглобина, лейкоцитарной формулой, скоростью оседания эритроцитов и гематокритом. Какой микроэлемент входит в состав гемоглобина? Это железо.
Как уже было отмечено, пониженный уровень может послужить причиной возникновения анемии. Показатель эритроцитов сообщает о присутствии красных кровяных телец в клетках, которые в своем составе содержат гемоглобин, играя при этом роль некоего транспорта для кислорода, который нужен тканям. Эритроциты выполняют защитную роль, так как принимают участие в иммунных и аутоиммунных процессах, абсорбируя токсины.
Они, помимо всего прочего, отвечают и за доставку аминокислот от пищеварительных органов к тканям человеческого организма. А вот какие ионы входят в состав гемоглобина?

В расшифровке анализа присутствует такой показатель как гематокрит, демонстрирующий соотношение объема эритроцитов к плазме. Собственно, этот показатель и помогает определить, имеются нарушения процесса соединения гемоглобина или нет. Данное значение фиксируют в процентном соотношении. Нормальным показателем у женщин до тридцати лет является 43,5 %, а у мужчин – 49 %. У женщин в возрасте от 50 до 65 лет это значение доходит до 45 %, а у мужчин – до 49 %.
Все приведенные значения при общей совокупности дают возможность доктору своевременно определить начало развития той или иной патологии, осуществить своевременное лечение для пациента.
Что входит в состав гемоглобина?
Итак, гемоглобин служит главным компонентом эритроцитов. В его состав входит «гем», что представляет собой комплексное соединение железа, и «глобин». Непосредственно в крови данный белок присутствует в форме соединения гемоглобина с кислородом.
Также существует форма другого вида гемоглобина, который называется оксигемоглобин. Этот тип остается без кислорода и находится в артериальной крови. Что касается венозной крови, то в ней присутствуют обе представленные формы. Какой микроэлемент входит в состав гемоглобина и эритроцитов?
Гематокрит
Важную роль в рамках диагностирования анемических патологий играет определение значения концентрации гемоглобина, общей величины гематокрита. Напомним, что этот элемент является объемом красных клеток, содержащихся в крови. Таким образом, анемию, как правило, диагностируют при следующих показателях:
Среди мужчин, при факте снижения концентрации гемоглобина менее 140 грамм на литр, а показатель гематокрита ниже 42 %.
Среди женщин, при снижении меньше 120 грамм на литр и 37 % гематокрита.
В том случае, если была диагностирована анемия, концентрация данного вещества, что входит в состав гемоглобина, может колебаться. Это зависит от формы и общей степени ее выраженности.
Анемия, которая вызывается дефицитом железа в крови, сообщает об умеренном снижении гемоглобина, то есть не больше, чем 114 грамм на литр. На фоне сильных кровопотерь данный показатель может приобретать значение, равное 85 граммам на литр. Минимальным показателем этого вещества в крови у живых людей является 10 грамм на литр.
В состав гемоглобина входят молекулы белка.

Заключение
Для того чтобы повысить уровень гемоглобина и предотвратить появление анемии необходимо обратить внимание на питание, которое обязательно должно являться сбалансированным и полноценным. В особенности следует остановиться на продуктах, которые содержат железо.
Самые богатые на это вещество: говядина, куриные яйца, курага и грецкие орехи. В рацион также следует включить и кисломолочные изделия. Так, мы выяснили, что входит в состав гемоглобина.
Kravec13
Ученик
(127),
закрыт
3 года назад
Hannah Sykes
Мастер
(1116)
4 года назад
По мере созревания в костном мозге уже на стадии базофильных эритробластов появляется гемоглобин. Завершается биосинтез гемоглобина в ретикулоцитах, содержащиеся в русле крови. В зрелом эритроците содержание гемоглобина постоянный. Он может только уменьшаться при частичном гемолизе за счет выхода части гемоглобина с эритроцита, чего в норме практически не наблюдается. Важную роль в биосинтезе гемоглобина играют витамин ВИ2, В6, фолиевая кислота и микроэлемент Fe2 +, входящая в состав простетической группы (гем). В молекуле гемоглобина содержится 1 молекула глобина и 4 молекулы гема. Гем содержит в своем составе атом железа, способный присоединять или отдавать кислород. При этом валентность железа не изменяется (он остается двухвалентного).
Белковая часть гемоглобина – глобин – состоит из 4 цепей. Эритроциты взрослого человека содержат 2а-и 2В-цепи. Такой гемоглобин носит название АНb (от англ. Adult – взрослый). В крови плодов является FHb (от англ. Fetus – плод), содержащий 2а-и второе-цепи. FHb отличается лучшей способностью транспортировать кислород. Поэтому в крови плода, несмотря на низкий Р02, образуется достаточно большое количество оксигемоглобина. Перед рождением плода эритроциты с FHb постепенно исчезают из крови, заменяясь эритроцитами, содержащими АНb.
Гемоглобин, участвуя в транспорте газов, образует различные соединения. Присоединив кислород, он превращается в оксигемоглобин (НЬ02). Гемоглобин, отдавший кислород тканям, называется восстановленным, или дезоксигемоглобином.
Он имеет темный цвет. В венозной крови часть гемоглобина соединена с С02 – карбгемоглобин (НЬСО).
Под действием сильных окислителей железо превращается в трехвалентное. Иногда образуется прочная соединение с 02 – метгемоглобин (MtHb). В норме метгемоглобин образуется в очень малых количествах. Этому препятствуют соответствующие ферменты, содержащиеся в эритроцитах.
При вдыхании воздуха, содержащего угарный газ, образуется прочная соединение – карбоксигемоглобин (НЬСО). Сродство гемоглобина к CO в сотни раз превышает сродство его до 02, и поэтому возможность транспорта кислорода в этих условиях резко ухудшается. Но при дыхании свежим воздухом, особенно богатым на кислород, при несмертельного отравлении CO медленно отщепляется и киснетранспортна функция гемоглобина восстанавливается.
Структура глобина влияет на устойчивость (резистентность) эритроцитов. Например, эритроциты с FHb менее устойчивы и в русле крови (при легочном дыхании) активно разрушаются. Меняются устойчивость мембраны и даже форма эритроцита и при патологических типах гемоглобина – S, С и т. д. Эти разновидности гемоглобина особенно часто наблюдаются у жителей экваториальных стран. Эритроциты, содержащие F-гемоглобин, большие по размеру. Концентрация • эритроцитов в крови новорожденных выше, чем у взрослых (в 5,9-10в-12 / л). В крови доношенных детей FHb составляет около 70%. После рождения активно гемолизоваии эритроциты заменяются новообразованными, содержащие АНb. Но в первые сутки жизни гемолиз преобладает над процессом создания, поэтому концентрация эритроцитов снижается. Низкая концентрация их в возрасте 5-6 мес (до 4,0-4,1 10в-12 / л). Как правило, уровень эритроцитов в крови детей до периода полового созревания остается несколько ниже, чем в крови взрослых. При старении количество эритроцитов в крови изменяется мало.
При подъеме на высоту стимулируется эритропоэз и увеличивается общее количество эритроцитов (абсолютный эритроцитоз). Лри подъеме на каждый километр и длительном пребывании на такой высоте количество эритроцитов в крови увеличивается на 0,7 XX 10в-12 / л.
Источник: Интернет
Виталий
Мыслитель
(5400)
4 года назад
железо легко вступает в связь с кислородом и именно соединение кислорода с железом окрашивает кровь в красный цвет.
Кислород – это окислитель. Но союз кислорода и железа в гемоглобине – невероятное исключение. Здесь никакого окисления не происходит. Ион железа как бы “берет за руку” молекулу кислорода и “ведет” ее к месту свершения действительного окисления и там ее “отпускает”. За это свойство английский физиолог, один из основателей науки о дыхании Дж. Баркрофт, назвал гемоглобин “самым удивительным веществом в мире”. Кроме того, гемоглобин выполняет и другую очень важную функцию – выведение с места окисления углекислого газа. И если кислород вводится в клетку гемом, то углекислоту оттуда “выносит” глобин.
