В каких условиях насыщение гемоглобина кислородом снижается
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 июля 2013;
проверки требуют 29 правок.
Эффект Вериго — Бора (синонимы — эффект Вериго, эффект Бора) — зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в альвеолярном воздухе и крови, при снижении которого сродство кислорода к гемоглобину повышается, что затрудняет переход кислорода из капилляров в ткани. Эффект этот был открыт независимо друг от друга Б. Ф. Вериго в 1892 году[1] и датским физиологом К. Бором в 1904 году[2].
История открытия[править | править код]
Основу разработки проблемы гипоксии заложил русский учёный-физиолог И. М. Сеченов фундаментальными работами по физиологии дыхания и газообменной функции крови. Большое значение имеют также исследования русского физиолога Б. Ф. Вериго по физиологии газообмена в лёгких и тканях. Опираясь на идеи Сеченова о сложных формах взаимодействия между диоксидом углерода и кислородом в крови (Вериго работал в лабораториях Сеченова, И. Р. Тарханова и И. И. Мечникова), он впервые установил зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в крови.
Биохимический механизм[править | править код]
Эффект Вериго — Бора: влияние pH на кривую насыщения гемоглобина кислородом
В клетках периферических тканей органическое топливо окисляется в митохондриях с использованием кислорода (клеточное дыхание), доставляемого гемоглобином из лёгких; при этом в качестве продуктов образуются углекислый газ, вода и другие соединения. Образование углекислого газа в тканях одновременно приводит и к повышению концентрации ионов H+ (то есть к понижению pH), поскольку при гидратации CO2 образуется H2CO3 — слабая угольная кислота, диссоциирующая на ионы H+ и бикарбонат-ионы:
H2CO3 ⇄ H+ + HCO3-.
Гемоглобин переносит значительную долю (около 20 %) общего количества CO2 и ионов H+, образующихся в тканях и поступающих в лёгкие и почки, обеспечивающих выделение этих продуктов.
За много лет до открытия этого механизма было обнаружено, что на связывание кислорода гемоглобином очень сильное влияние оказывает pH и концентрация CO2: при присоединении CO2 и ионов H+ способность гемоглобина связывать O2 снижается. Действительно, в периферических тканях с относительно низким значением pH и высокой концентрацией CO2 сродство гемоглобина к кислороду падает. И наоборот, в лёгочных капиллярах выделение CO2 и сопутствующее ему повышение pH крови приводит к увеличению сродства гемоглобина к кислороду. Это влияние величины pH и концентрации CO2 на связывание и освобождение O2 гемоглобином и называют эффектом Вериго — Бора.
Реакция связывания кислорода гемоглобином в виде
Hb + O2 ⇄ HbO2
в действительности отражает неполную картину, поскольку не учитывает дополнительные лиганды H+ и CO2.
Чтобы объяснить влияние концентрации ионов H+ на связывание кислорода, следует записать эту реакцию в иной форме:
HHb+ + O2 ⇄ HbO2 + H+,
где HHb+ — протонированная форма гемоглобина. Из этого уравнения следует, что кривая насыщения гемоглобина кислородом зависит от концентрации ионов H+. Гемоглобин связывает и O2, и ионы H+, но между этими двумя процессами существует обратная зависимость. Если парциальное давление кислорода велико (что наблюдается, например, в лёгких), то гемоглобин связывает его, освобождая при этом ионы H+. При низком парциальном давлении кислорода (что имеет место в тканях) связываться с гемоглобином будут ионы H+.
Эффективность связывания гемоглобином углекислого газа (с образованием карбаминогемоглобина, чаще именуемого карбгемоглобином[3]) находится в обратной зависимости от связывания кислорода. В тканях часть избыточного CO2 связывается с гемоглобином, сродство последнего к O2 снижается, и происходит высвобождение кислорода. В лёгких же связывается избыток O2 воздуха, тем самым сродство гемоглобина к CO2 уменьшается, и CO2 выделяется в альвеолярный воздух, способствуя лёгкому закислению крови за счёт ионов H+, возникающих при диссоциации угольной кислоты (см. выше).
Описанные зависимости делают молекулу гемоглобина великолепно приспособленной к осуществлению совместного переноса эритроцитами кислорода, углекислого газа и ионов H+[4].
См. также[править | править код]
- Эффект Холдейна (открыт Джоном Скоттом Холдейном)
Примечания[править | править код]
- ↑ Verigo B. F. Zur Frage über die Wirkung des Sauerstoff auf die Kohlensäureausscheidung in den Lungen // Archiv für die gesammte Physiologie des Menschen und der Thiere : статья. — 1892. — № 51. — С. 321—361.
- ↑ Chr. Bohr, K. Hasselbalch, and August Krogh. Concerning a Biologically Important Relationship — The Influence of the Carbon Dioxide Content of Blood on its Oxygen Binding // Skand. Arch. Physiol. : статья. — 1904. — № 16. — С. 401—412.
- ↑ Карбгемоглобин // Биологический энциклопедический словарь (рус.).
- ↑ Ленинджер А. Основы биохимии: В 3-х томах. Том 1. — М.: Мир, 1985. — С. 208—210. — 367 с.
Литература[править | править код]
- Вериго эффект // Большой медицинский словарь (рус.). — 2000.
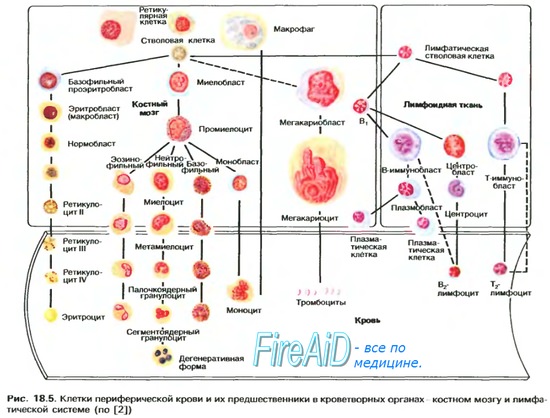
Факторы, влияющие на кривую насыщение гемоглобина кислородом. Эффект Бора. Структура и свойства миоглобина и гемоглобина.
Подробности
Кривая диссоциации гемоглобина – S-образной формы <=кислор.насыщение SO2=100%•[HbO2]/([Hb]+[HbO2]); но присоединение идет как 4-х-стадийный процесс =>4 константы равновесия =>форма сложнее, не такая, как у миоглобина (Mb+O2-MbO2).
Интерпретация кривой диссоциации гемоглобина:
1. В области высоких напряжений – почти горизонт. =>даже при знач.снижении РО2 насыщение Hb изменяется слабо.
2. В середине графика – более вертик. =>при возросших потребностях =>vPO2 в венозной крови =>насыщение падает очень сильно =>О2 насыщает ткани лучше. Артерио-венозная разница [O2] =0,05 (0,2 – в арт.крови, 0,15 – в венозной =>использ-ся только 25%).
Факторы, влияющие на кривую диссоциации гемоглобина:
1. Температура. увеличение температуры =>кривая – вправо, снижеается угол наклона (снижение сродства);
2. Влияние рН (эффект Бора): снижение рН =>уменьшение угла наклона (снижение сродства). увеличивается РСО2 = снижается рН +собств.эффект на гемоглобин.
Эффект Бора.
Эффект Вериго — Бора (синонимы — эффект Вериго, эффект Бора) — зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в альвеолярном воздухе и крови, при снижении которого сродство кислорода к гемоглобину повышается, что затрудняет переход кислорода из капилляров в ткани.
Биологический смысл кривой диссоциации гемоглобина:
1. В легких – поглощение О2 => снижение O2 => снижение сродства. Но одновременно – выводится СО2 => повышается сродство.
2. В ткани – выделение из тканей СО2 => кривая вправо => снижение сродства => лучшее насыщение тканей О2.
Гемоглобин представляет собой белок глобин, связанный с четырьмя группами гемма – порфириновыми железосодержащими группировками. В свою очередь глобин состоит из двух одинаковых частей, каждая из которых включает две полипептидные цепи. Гемоглобин диссоциирует на четыре субъединицы примерно одинакового молекулярного веса, в состав каждой из которых входит одна полипептидная цепь и один гем.
Миоглобин — дыхательный пигмент, служащий для запасания О2 в мышцах позвоночных,- эквивалентен одной субъединице гемоглобина. Атом двухвалентного железа, включенный в порфириновое кольцо тема, образует координационные связи с четырьмя атомами азота, входящими в состав пиррольных группировок. Оставшиеся две координационные связи используются для присоединения тема к имидазольному кольцу глобина и для связывания кислорода.
Гемоглобин, присоединивший О2, называется оксигемоглобином, а свободный от кислорода — дезоксигемоглобином. Свойства разных видов гемоглобина в процессе связывания кислорода различны и зависят от особенностей структуры молекулы глобина. Когда кислород соединяется с гемоглобином и образует оксигемоглобин, железо не окисляется. В том случае, если железо в группе тема все же становится трехвалентным, образуется метгемоглобин, не способный связывать кислород и, следовательно, не может участвовать в его переносе. Метгемоглобин образуется в организме в естественных условиях, однако в эритроцитах содержится фермент метгемоглобинредуктаза, восстанавливающий его до “нормального” гемоглобина с двухвалентным железом. Некоторые вещества (нитриты и хлораты) способны либо окислять гемоглобин, либо инактивировать метгемоглобинредуктазу. При этом увеличивается содержание в крови метгемоглобина и нарушается перенос кислорода.
Сродство гемоглобина к окиси углерода (угарному газу, СО) примерно в 200 раз выше, чем к кислороду. В связи с этим даже при очень низких парциальных давлениях угарного газа он может вытеснять кислород из соединения с гемоглобином и полностью насыщать последний. Это приводит к резкому снижению поступления кислорода к тканям.
Гемоглобин, насыщенный окисью углерода, называется карбоксигемоглобином. При связывании гемоглобина с угарным газом окислительные обменные процессы страдают в такой же степени, как и при отсутствии кислорода.
Несмотря на то, что исследование кислотно-основного состояния, строго говоря, подразумевает исследование только величины pH (концентрации ионов H+), в реальности в него также включается исследование физиологически важных газов, присутствующих в крови – O2 и CO2. Анализ газов показывает эффективность газообмена по величинам парциальных давлений – pO2 и pCO2.
Через альвеолярную мембрану молекулы любых газов перемещаются диффузно по градиенту концентрации. Молекулы O2 атмосферного воздуха поступают из альвеол в кровь, а молекулы CO2 из крови в альвеолы до тех пор пока их парциальные давления не выровняются.
Величина парциального давления – это процентная доля газа в общем объеме.
Углекислый газ
Концентрация СО2 в альволярном воздухе столь низка, а в крови столь высока, что диффузия этого газа в альвеолы чрезвычайно эффективна и скорость его удаления зависит только от альвеолярной вентиляции – общего объема воздуха, транспортируемого в минуту между альвеолами и атмосферой (“скорости выдувания”).
Следовательно,
- при усиленной вентиляции легких углекислый газ быстро выводится, и показатель pCO2в крови снижается. Это означает потерю организмом угольной кислоты (ионов H+), что является причиной защелачивания крови – алкалоза, называемого дыхательным или респираторным.
- при недостаточной альвеолярной вентиляции величина рСО2 повышается, что свидетельствует о недостаточном его удалении и накоплении H2CO3. Иными словами, повышение в крови показателя рСО2 является причиной дыхательного ацидоза.
Увеличенное pCO2 (гиперкапния) всегда свидетельствует о снижении альвеолярной вентиляции.
Кислород
Вопросы, связанные с оксигенацией крови и транспортом кислорода более сложны. Связано это с тем, что в виде свободных (растворенных) молекул O2 находится лишь небольшая доля общего кислорода крови. Основная часть кислорода связана с гемоглобином (оксигемоглобин) и истинное содержание кислорода зависит от двух дополнительных параметров – концентрации Hb и насыщения (сатурации) гемоглобина кислородом.
Оксигемоглобин
Оксигемоглобин (HbО2) – процентное содержание в крови, является отношением фракции оксигемоглобина (HbО2) к сумме всех фракций (общему гемоглобину).
Насыщение гемоглобина кислородом
Насыщение гемоглобина кислородом (HbOSAT, SО2), представляет собой отношение фракции оксигенированного гемоглобина к тому количеству гемоглобина в крови, который способен транспортировать О2.
Отличия между двумя показателями HbО2 и HbOSAT заключаются в том, что у пациентов возможно наличие в крови такой формы гемоглобина, которая не способна акцептировать О2 (Hb‑CO, metHb, сульфоHb). Но так как большинство больных не имеют в крови повышенного содержания этих форм гемоглобина, значения HbО2 и SО2 обычно очень близки.
Например, если при отравлении нитритами количество metHb составляет 15%, тогда величина HbО2 никогда не сможет превысить 85%, но насыщение (HbOsat) может быть различно – от максимума (HbOsat=95-98%) при полном насыщении до низких величин при отсутствии кислорода.
Показатель насыщения кислородом показывает процент доступных мест связывания на гемоглобине.
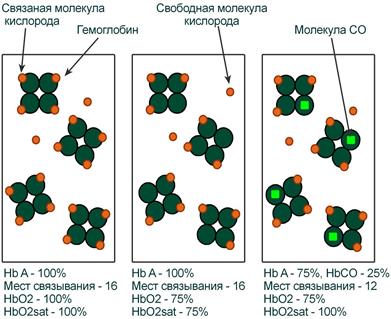
Иллюстрация понятий оксигемоглобина (HbO2) и насыщения гемоглобина (HbO2sat)
Парциальное давление кислорода (pO2)
Парциальное давление O2 выступает как движущая сила, приводящая к насыщению гемоглобина кислородом. И хотя, как правило, чем выше pO2 тем выше HbOsat, эта зависимость не является линейной.

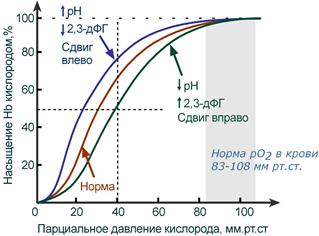
Кривая диссоциации гемоглобина в норме и
при изменении pH и концентрации 2,3-дифосфоглицерата
В центральной части кривой насыщения (или кривой диссоциации) гемоглобина малейшие сдвиги pO2 приводят к резким изменениям насыщения гемоглобина. И наоборот, при высоком pO2 (80-90-100 мм рт.ст) кривая становится плоской, насыщение гемоглобина мало зависит от колебаний кислорода в плазме.
Сдвиг влево происходит при защелачивании и снижении концентрации 2,3-дифосфоглицерата и сигнализирует об увеличении сродства кислорода к гемоглобину (в легких). Сдвиг вправо – это снижение сродства кислорода к гемоглобину (в тканях), обеспечивается закислением среды и накоплением 2,3-дифосфоглицерата.
Показатель pO2 не отражает содержание кислорода в цельной крови! Но хотя pO2 и не показывает общее количество кислорода в крови, но это общее количество зависит от pO2 через показатель сатурации гемоглобина.
В свою очередь имеются факторы, влияющие на величину pO2:
1. Альвеолярная вентиляция. Хотя она влияет как на pO2 так и на pCO2, но доля кислорода в альвеолах при гипервентиляции может лишь слегка увеличиться, приближаясь к pO2 атмосферного воздуха, при гиповентиляции – стремительно падает, вытесняясь поступающим из крови CO2. В то же время доля CO2 в альвеолах быстро снижается при усиленной вентиляции.
2. Вентиляционно-перфузионное соотношение, определяется тем, что
- не вся кровь, притекающая к легким, соприкасается с хорошо вентилируемыми альвеолами (спадение альвеол, уплотнение стенки).
- не все хорошо вентилируемые альвеолы получают достаточно крови (правожелудочковая сердечная недостаточность).
3. Концентрация кислорода во вдыхаемом воздухе (FiO2, fraction of inspired oxygen).
В таблице приведены сравнительные величины концентрации кислорода и углекислого газа в воздухе, крови и тканях.
Необходимо обратить внимание на перепады концентраций кислорода и углекислого газа в крови и альвеолярном воздухе. Важной особенностью является то, что pO2 в альвеолярном воздухе и артериальной крови очень близки, т.е. в обычных условиях глубоким и/или частым дыханием невозможно повысить потребление кислорода и насыщение им гемоглобина. В то же время разность концентраций pCO2 в венозной крови и альвеолярном воздухе позволяет эффективно его удалять при частом дыхании.
| pO2, мм рт.ст. | pCO2, мм рт.ст | |
| Вдыхаемый воздух | 159 | 0,23 |
| Альвеолярный воздух | 105-110 | 40 |
| Артериальная кровь | 83-108 | 35-45 |
| Ткани | 10-20 | 50-60 |
| Венозная кровь | 35-49 | 46-51 |
| Выдыхаемый воздух | 116 | 32 |