В мазках крови пациента с апластической анемией преобладают
Апластическая анемия — это заболевание крови, форма анемии, при которой в костном мозге недостаточно тромбоцитов (эритроцитов), эритроцитов и лейкоцитов. Это редкое заболевание, которое может возникнуть в любом возрасте. Болезнь может развиваться медленно или быстро.
Что такое апластическая анемия
Апластическая анемия — это патологическое состояние организма, при котором костный мозг перестает вырабатывать все три типа клеток крови: красные кровяные тельца (эритроциты), белые кровяные тельца (лейкоциты) и тромбоциты (тромбоциты). Это происходит, когда по какой-то причине в костном мозге уменьшается количество стволовых клеток, из которых развиваются все клетки крови.
Точнее сказать — это синдром недостаточности костного мозга, характеризующийся снижением количества эритроцитов, лейкоцитов, тромбоцитов в крови и гипоплазией костного мозга с менее чем 30% гематопоэтических клеток.
Что такое апластическая анемия
Апластическая анемия подразделяется на первичную и вторичную.
- Первичная — анемия Фанкони, врожденный склероз и семейная апластическая анемия.
- Вторичная — анемия, вызванная химическими веществами, лекарствами, вирусами.
Распространенность
Апластическая анемия — относительно редкое заболевание: заболеваемость составляет 5-10 случаев на миллион людей в год.
Симптомы апластической анемии
Больные жалуются на нарастающую слабость, утомляемость, нехватку воздуха. Возможно кровотечение, быстрее возникают синяки. У пациентов с анапластической анемией более частые инфекции, высокая температура с ознобом — серьезное состояние, требующее безотлагательного медицинского обследования и лечения.
Часто встречающиеся симптомы:
- общая слабость;
- быстрая утомляемость;
- одышка в покое и во время упражнений;
- частое сердцебиение;
- аритмичное сердцебиение;
- бледная кожа;
- кровотечение из ран;
- синяки на коже;
- кровотечение из носа;
- десневое кровотечение;
- общие инфекции;
- высокая температура;
- головная боль.
Высокая температура
Кровотечение из носа
Этиология. Причины развития апластической анемии
Апластическая анемия возникает при повреждении костного мозга, который производит стволовые клетки крови. Производство клеток может замедляться, они могут полностью разрушаться или производиться в деформированном, дисфункциональном виде. В 65% случаях причина заболевания неясна.
Врожденные патологии. Врожденная апластическая анемия встречается редко. Наиболее частой формой врожденного заболевания является синдром Фанкони: пациенты с низким ростом, измененной пигментацией кожи, различными проблемами с почками. Генетическое тестирование в этом случае выявляет хромосомные аберрации.
Лекарства и токсины. Наиболее частой известной причиной апластической анемии является воздействие лекарств и токсинов окружающей среды.
Причина апластической анемии – воздействие лекарств
Недостаточность костного мозга, наряду с апластической анемией, часто вызвана токсинами — органическими химикатами (бензолом, толуолом, инсектицидами, нефтяными дистиллятами).
Что касается лекарств, апластическая анемия вызывается:
- антибиотиком хлорамфениколом;
- пеницилламином — используется для лечения заболеваний суставов;
- карбамазепином и фенитоином — используется для лечения эпилепсии;
- ацетазоламидом — диуретик;
- цитотоксическими препаратами, используемыми для лечения рака.
Встречаются случаи апластической анемии, развивающиеся на фоне вирусных инфекций — парвовирус B19, вирусы гепатита B и C, вирусы Эпштейна-Бар (EBV), цитомегаловирусы (CMV). Очень редко апластическая анемия возникает при беременности.
Цитотоксические препараты подавляют и убивают клетки костного мозга, но костный мозг восстанавливается довольно быстро, после прекращения их приема. Угнетает костный мозг и лучевая терапия. Иногда химиотерапией намеренно разрушают костный мозг при подготовке к трансплантации.
Течение болезни
Заболевание может развиваться очень медленно, а может возникать очень внезапно. Обычно апластическая анемия развивается незаметно и подозревается при возникновении комплекса различных симптомов. В некоторых случаях, например, при лечении рака, апластическая анемия довольно распространена и считается осложнением, в других случаях диагноз может быть отложен.
У пациента отсутствуют все клетки крови, что вызывает множество сопутствующих симптомов.
- Недостаток эритроцитов характеризуется одышкой, слабостью, утомляемостью, бледностью, головной болью, шумом в ушах.
- Недостаток тромбоцитов приводит к длительному кровотечению во время травмы или менструации, появлению синяков даже от малейших травм, покраснению глаз, спонтанному кровотечению из носа и десен.
- Отсутствие лейкоцитов характерно для частых инфекций, более трудно заживающих ран, лихорадки, иногда с ознобом.
Шум в ушах
Диагностика апластической анемии
Диагноз ставится на основании физического обследования — увеличение печени, возможные аномалии развития, изменение пигментации, быстрый рост, высокое небо, клинических симптомов, лабораторных тестов.
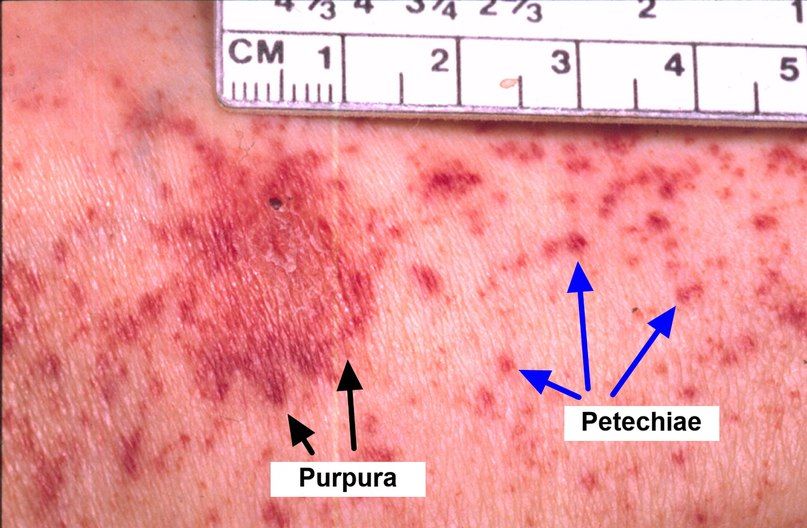
Важные клинические симптомы включают слабость, одышку (указывающую на возможное уменьшение количества эритроцитов), лихорадку, озноб, боль в горле (указывающую на возможную инфекцию из-за уменьшения лейкоцитов), кровотечения или синяки в различных частях тела, петехии (небольшие кровотечения) в слизистой оболочке рта (из-за уменьшения тромбоцитов). Пациент может быть бледным и иметь язвы во рту.
При осмотре глазного дна часто наблюдаются кровоизлияния в сетчатку.
При обследовании важно определить показатели крови, оценить степень истощения костного мозга и, если возможно, найти причину.
Анализ крови:
- Выявляется уменьшение количества всех клеток крови (эритроцитов (эритроцитопения), лейкоцитов (лейкоцитопения), тромбоцитов (тромбоцитопения)) – тогда состояние называется панцитопенией.
- Уменьшение количества нейтрофилов указывает на тяжесть апластической анемии: 0,5 х 10 9/ л показывают тяжелую и 0,2 х 10 9 / л – очень тяжелую апластическую анемию.
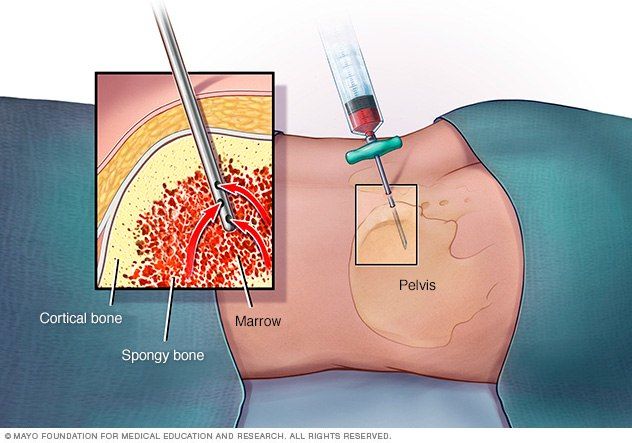
В случае заметного уменьшения количества кровяных телец требуется срочная консультация гематолога. Чтобы поставить диагноз, он выполняет аспирацию костного мозга или биопсию трепана, при которой из костного мозга берется небольшое количество клеток для более точного исследования. Это исследование помогает отличить апластическую анемию от других заболеваний крови.
Анализ крови
Биопсия трепан
Также проводится УЗИ внутренних органов. При необходимости цитогенетические исследования.
Лечение
Если возможно, следует устранить причину недостаточности костного мозга и апластической анемии. Иногда функция костного мозга восстанавливается, когда причина легкая, при только симптоматическом лечении легкой апластической анемии. Если количество клеток не очень велико, достаточно наладить питьевой режим и перейти на специальную диету.
Тяжелые и очень тяжелые формы апластической анемии представляют собой опасные для жизни состояния, требующие срочного и серьезного лечения. При температуре выше 38 o C в течение более двух часов пациента госпитализируют и лечат антибиотиками.
Лечение апластической анемии антибиотиками
Может потребоваться дополнительная инфузия тромбоцитов, когда риск кровотечения становится высоким — количество тромбоцитов падает ниже 10 x 10 9/ л. Инфузия эритроцитов назначается при тяжелых симптомах анемии.
Трансплантация костного мозга является методом выбора для лечения пациентов с тяжелой и очень тяжелой апластической анемией в возрасте до 50 лет. Пациенты старше 50 лет получают иммуносупрессивную терапию антитимоцитарным глобулином и циклоспорином.
В случае разрушения костного мозга из-за аутоиммунного процесса и невозможности трансплантации нельзя использовать иммунодепрессанты — циклоспорин, антитимоцитарный глобулин, метилпреднизолон, подавляющие атаку организма на костный мозг. Назначаются стимуляторы костного мозга — филрастин, колониестимулирующий фактор, эритропоэтин, др. Это препараты, стимулирующие костный мозг производить более специфические клетки. Лечение этими препаратами часто сочетается с иммуносупрессивной терапией.
В профилактических целях могут быть назначены антибиотики для предотвращения инфекций, поскольку сопротивляемость организма резко снижается.
В случае апластической анемии, вызванной лучевой терапией или химиотерапией для лечения рака, функция костного мозга восстанавливается после прекращения лечения.
Беременным женщинам делают переливание крови, и функция костного мозга также восстанавливается после родов, но если этого не происходит, лечение жизненно необходимо.
Осложнения
При тяжелой и очень тяжелой апластической анемии восприимчивость к различным инфекциям значительно увеличивается, и из-за низкого количества тромбоцитов возможно кровотечение. После трансплантации может возникнуть такая реакция отторжения, как сыпь, диарея, проблемы с печенью. Высокие дозы циклоспорина могут повышать артериальное давление, что приводит к почечной недостаточности.
Поделиться ссылкой:

Апластическая анемия (АА) — это заболевание, характеризующееся панцитопенией, гипоклеточностью костного мозга при отсутствии аномальных клеток или фиброза костного мозга. Первое описание апластической анемии было получено в 1888 году Паулем Эрлихом — это была молодая беременная женщина, умершая от тяжелой анемии и нейтропении, на аутопсии было выявлено замещение межтрабекулярных пространств костного мозга жировой тканью, т. е. отсутствие гемопоэза. Термин «апластическая анемия» был введен французским гематологом А. М. Шоффаром в 1904 году и применен стохастически. Хоть АА и не является распространенным заболеванием, трагичность каждого отдельного случая и фатальные последствия вызывают к ней значительный интерес [1, 3, 4].
АА может носить как наследственный, так и приобретенный характер. Несколько редких врожденных заболеваний, включая анемию Фанкони, синдром Швахмана-Даймонда, врожденный дискератоз, первично характеризуются апластическим типом гемопоэза [2].
В большом количестве литературных источников начиная с XX века описаны различные химические и лекарственные соединения, вызывающие это заболевание; широко известно влияние на показатели крови бензола, а также случаи апластической анемии после введения хлорамфеникола. Хлорамфеникол является широко известным лекарством, документально зарегистрированным как фактор развития апластической анемии. Хотя этот препарат при очень высокой дозе оказывает непосредственно миелосупрессивное действие из-за его влияния на митохондриальную ДНК, возникновение апластической анемии носит идиосинкразический характер, предположительно связанный с унаследованной чувствительностью к нитрозосодержащим токсичным промежуточным продуктам. Риск развития апластической анемии у пациентов, получавших хлорамфеникол, составляет примерно 1 на 20 000, то есть в 25 раз больше, чем в общей популяции. Хотя в индустриальных странах его использование в качестве антибиотика прекращено, до сих пор появляются сообщения о фатальной апластической анемии при его топическом или системном использовании.
Известно, что некоторые препараты также могут вызывать селективные цитопении и агранулоцитоз, которые обычно обратимы и проходят после прекращения воздействия агента. Эти обратимые реакции не коррелируют с риском апластической анемии, ставя под сомнение эффективность рутинного мониторинга клинического анализа крови в качестве метода диагностики апластической анемии [1].
Исследования in vitro и данные клинических наблюдений привели к выводу, что основой для большинства случаев приобретенной апластической анемии служит атака цитотоксическими Т-лимфоцитами CD34+ клеток и стволовых клеток крови (СКК). Иммунное повреждение клеток костного мозга после лекарственной, вирусной или токсической аплазии костного мозга может быть результатом индукции неоантигенов, провоцирующих вторичную Т-опосредованную атаку на кроветворные клетки. Спонтанное или митоген-индуцированное увеличение продукции мононуклеарами интерферона-γ, IL-2 и фактора некроза опухолей-α (TNF-α) ингибирует дифференцировку гемопоэтических клеток [1]. Секреция интерферона-γ является результатом повышения регуляции транскрипционного фактора T-bet и апоптоза CD34+ клеток, частично опосредованного FAS-зависимым путем [3].
В ранних лабораторных экспериментах удаление лимфоцитов из апластического костного мозга увеличивало число колоний клеток в культуре тканей, а их внедрение в нормальный костный мозг подавляло гематопоэз in vitro. Эффекторные клетки были идентифицированы при помощи иммунофенотипирования активированных цитотоксических CD8+ Т-клеток, экспрессирующих Th1-цитокины, в частности γ-интерферон. CD8 клетки могут определяться непосредственно в крови при помощи:
- проточной цитометрии T-клеточного рецептора (TCR);
- спектрального анализа комплемент-определяющего региона (CDR2);
- секвенирование области CDR3 для установления молекулярного клона.
Также снижение количества регуляторных Т-клеток (CD4+, CD25+, FoxP3+) способствует увеличению аутореактивной популяции CD8+ CD28– Т-клеток, которая индуцирует апоптоз аутологичных гемопоэтических клеток. Т-регуляторные клетки являются компонентами иммунной системы, подавляющими иммунные реакции других клеток, а также играющими роль в предотвращении аутоиммунных реакций [2].
АА может возникать из-за метаболической или иммунологической предрасположенности (полиморфизма генов) у восприимчивых лиц. В случае фенилбутазон-ассоциированной аплазии костного мозга происходит замедление процессов окисления и клиренса соответствующего соединения, ацетанилида, по сравнению с нормальной контрольной группой, что предполагает избыточное накопление лекарственного средства как потенциального пускового механизма развития аплазии.
Для пациентов как с приобретенной, так и с наследственной апластической анемией (Фанкони, врожденный дискератоз) характерно наличие дефекта теломераз и восстановления теломер. Одной из характерных черт лейкоцитов при апластической анемии является укорочение теломер, причиной чему предполагали деплеции стволовых клеток. Однако анализ наследования в больших родословных продемонстрировал, что X-связанная форма врожденного дискератоза была вызвана мутациями в DKC1 (dyskeratosis congenita 1), идентификация мутаций в TERC (Telomerase RNA Component) у пациентов с аутосомно-доминантным наследованием помогла выявить генетическую основу укорочения теломер [3].
Центральную роль в восстановлении структуры РНК играет шаблон РНК, кодируемый TERC, при этом теломераза, представляющая собой обратную транскриптазу, кодируемую TERT (Telomerase Reverse Transcriptase), удлиняет нуклеотидную последовательность; другие белки, включая дискерин, кодируемый DKC1, связаны с восстановлением теломер. Систематические исследования ДНК выявили мутации TERC и TERT у некоторых пациентов с приобретенной апластической анемией. У членов семей, имеющих данную мутацию, несмотря на нормальные или почти нормальные показатели крови, выявили уменьшенное количество CD34-клеток, плохую скорость образования гемопоэтических колоний, повышенный уровень гемопоэтического фактора роста, гипоцеллюлярные участки в костном мозге, и, конечно, короткие теломеры. Клиническое проявление этих аномалий проявлялось позже, чем при типичном дискератозе, и не вызывало характерных физических отклонений. Некоторые из пациентов с синдромом Швахмана-Даймонда (Shwachman-Bodian-Diamond) также имеют мутации гена SBDS.
АА может сосуществовать или, по-видимому, эволюционировать вместе с другими гематологическими заболеваниями, характеризующимися пролиферацией специфических клонов клеток, такими как пароксизмальная ночная гемоглобинурия (ПНГ) или миелодиспластический синдром (МДС). Наличие небольшого количества клонов также создает проблемы при постановке диагноза апластической анемии даже при использовании таких высокочувствительных методов диагностики, как фенотипический (проточная цитометрия для ПНГ) или цитогенетический (флуоресцентная гибридизация in situ (FISH) для MDS) анализ [1, 2].
Более пятидесяти процентов пациентов с АА имеют клон ПНГ-клеток, которые обнаруживаются проточной цитометрией по отсутствию мембранных белков, связанных с якорным гликозилфосфатидилинозитолом. Мутация в гене PIG-A в стволовой клетке нарушает синтез гликозилфосфоинозитола (GPI) и, следовательно, вызывает отсутствие экспрессии GPI-связанных белков на поверхности эритроцитов потомства, лейкоцитов и тромбоцитов (CD14, CD16 и CD24 для лейкоцитов, CD55 и CD59 для эритроцитов). Большинство колоний клонов этих клеток небольшие и не приводят к клиническим проявлениям гемолиза или тромбоза, но при ПНГ может преобладать разрушение костного мозга («апластическая анемия/синдром ПНГ»). Было высказано предположение о том, что при ПНГ значительное уменьшение количества белков на клеточной поверхности позволяет «избежать» атаки и выжить существующему мутантному клону. Ассоциация клона ПНГ с HLA-DR29, по-видимому, также позволяет им избежать иммунной атаки и служит предиктором отсутствия реакции на иммуносупрессивную терапию. Тем не менее существует мало конкретных экспериментальных доказательств различия в дифференцировке типов иммунных реакций или восприимчивости клонов ПНГ по сравнению с фенотипически нормальными популяциями клеток-мишеней.
Конечным результатом иммуноопосредованного повреждения костного мозга является уменьшение образования клеток крови в костном мозге. Количество CD34+ клеток и их производных у пациентов с апластической анемией заметно снижено [2].
Клинически AA не сопровождается увеличением лимфатических узлов, печени или селезенки. Основным проявлением заболевания является панцитопения: для клинического анализа крови характерно уменьшение содержания всех форменных элементов. На ранних стадиях можно наблюдать изолированную цитопению, чаще тромбоцитопению. Может присутствовать моноцитопения, что требует дифференциального диагноза с волосатоклеточным лейкозом. АА сопровождается снижением ретикулоцитарного индекса, относительное число ретикулоцитов обычно меньше 1 % и может быть равно нулю, абсолютное число ретикулоцитов — менее 40 000 в мкл (40×109/л), несмотря на высокие уровни эритропоэтина; анизоцитоз и пойкилоцитоз отсутствуют. Эти изменения в периферической крови сопровождаются гипоклеточностью костного мозга без аномальных или злокачественных клеток или фиброза. Необходимо тщательное исследование мазков крови для исключения наличия диспластических клеток. При АА может быть увеличено содержание фетального Hb: у детей это требует проведения дифференциального диагноза с миелопролиферативными миелодиспластическими синдромами, такими как ювенильный миеломоноцитарный лейкоз или другие подтипы МДС [3, 4].

Критерии диагностики АА:
- концентрация гемоглобина (Hb) < 100 г/л;
- количество тромбоцитов < 50 × 109/л;
- количество нейтрофилов < 1–5×109/л;
- содержание ретикулоцитов < 60 × 109/л;
- фрагменты костного мозга в аспирате — гипоцеллюлярные с жировым замещением;
- отсутствие диспластических мегакариоцитов и бластных форм; их присутствие указывает на гипопластическую МДС либо эволюцию лейкемии

АА подразделяется на:
- Нетяжелую: отсутствие признаков тяжелой АА [4].
- Тяжелую: клеточность костного мозга < 25 % (или 25–50 % с < 30 % остаточных гемопоэтических клеток) + по меньшей мере 2 критерия из 3:
— количество нейтрофилов < 0–5×109/л;
— число тромбоцитов < 20×109/л;
— количество ретикулоцитов < 20×109/л.
- Очень тяжелую: те же признаки, что и при тяжелой, но количество нейтрофилов < 0–2×109/л;
Основным методом диагностики является проведение трепанобиопсии. Аспират костного мозга при АА обычно содержит трабекулы с пустыми, заполненными жиром межтрабекулярными пространствами и малым количеством гемопоэтических клеток. Могут присутствовать единичные лимфоциты, плазматические клетки, макрофаги и тучные клетки [1].
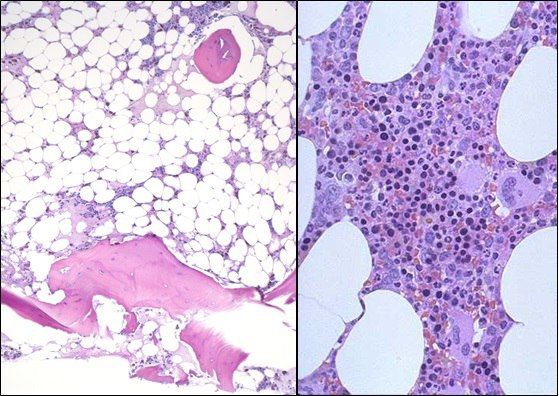
Слева — апластическая анемия, справа — норма
При выполнении цитогенетического анализа могут возникнуть трудности из-за низкой клеточности материала: для получения достаточного количества клеток может потребоваться несколько аспираций. Обнаружение клональных цитогенетических аномалий при апластической анемии является признаком наличия миелоидного заболевания. Переход к более новым методам, таким как сравнительная геномная гибридизация (CGH), позволяет обнаруживать анеуплоидии, делеции, дублирование и/или амплификации любого локуса.
Лучшим доказательством ключевой роли иммуноопосредованного механизма в патофизиологии АА является положительный ответ на иммуносупрессивную терапию у больных с апластической анемией: большинство пациентов демонстрируют гематологическое улучшение после транзиторного разрушения Т-клеток антитимоцитарным глобулином (ATGs), в случае рецидива ответ на ATG также сохраняется. По мере усиления иммуносупрессивной терапии, начиная с ранних попыток лечения при помощи кортикостероидов до использования агрессивных препаратов, таких как циклофосфамид в высоких дозах, увеличилось число сообщений о благоприятных результатах лечения, и иммунный механизм стал рассматриваться как ведущий. Влияние различных генетических факторов, микроокружения и индивидуальных характеристик иммунного статуса больного, вероятно, объясняет вариабельность клинической картины и реакций на проводимое лечение [1].
Терапия проводится при помощи следующих препаратов и методов:
- Антитимоцитарный глобулин (antithymocyte globulin, ATG), получаемый путем иммунизации животных (лошади или кролика) человеческими лимфоцитами; при монотерапии ATG клиническое улучшение наблюдается в 50–60 % случаев. Обычно для улучшения результата его назначают в комбинации с циклоспорином. Также на короткий срок назначаются кортикостероиды для снижения вероятности аллергической реакции и развития сывороточной болезни (лихорадка, сыпь и суставные боли), что может произойти приблизительно через 7 дней после введения ATG.
Количество тромбоцитов должно поддерживаться на уровне выше 10×10^9/л (по возможности — выше 20–30×109/л). При отсутствии ответа на ATG через 4 месяца может быть начат второй курс того же или другого препарата. В целом на комбинацию ATG и циклоспорина положительно реагирует до 80 % пациентов; - Циклоспорин показывает высокую эффективность в сочетании с ALG, но у пожилых людей иногда может использоваться и в виде монотерапии;
- Алемтузумаб (антитело против антигена CD52 лимфоцитов) показал эффективность примерно у 50 % пациентов (в небольших исследованиях), и обычно используется только при неэффективности ATG;
- Элтромбопаг (Eltrombopag) стимулирует образование тромбоцитов, а также может привести к увеличению количества эритроцитов и нейтрофилов;
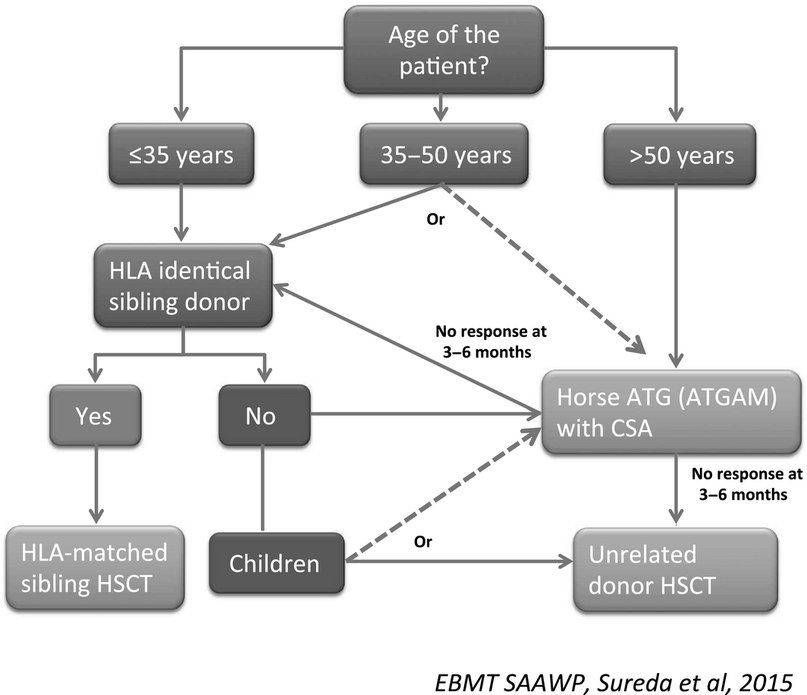
- Трансплантация стволовых клеток (ТСК). Проведение аллогенной ТСК у отдельных пациентов подразумевает возможность полного выздоровления. Кондиционирование проводится с циклофосфамидом без облучения, для снижения риска неприживления трансплантата и реакции «трансплантат против хозяина» используется циклоспорин. Сравнительный анализ эффектов ТСК и иммуносупрессивной терапии у лиц с апластической анемией до сих пор остается предметом дискуссий. Как правило, ТСК применяется у пациентов с тяжелой апластической анемией в возрасте менее 35 лет и имеющимся HLA-совместимым донором. У отдельных пациентов в возрасте старше 40 лет возможно применение ТСК с использованием немиелоаблативных режимов, но в основном у пациентов старшего возраста и лиц с меньшей тяжестью заболевания в первую очередь проводится иммуносупрессия;
- Гемопоэтические факторы роста. Гранулоцитарный колониестимулирующий фактор (G-CSF) может вызывать незначительный ответ, но обычно не приводит к стойкому улучшению. Другие факторы роста не показали свою эффективность [2, 3, 4].
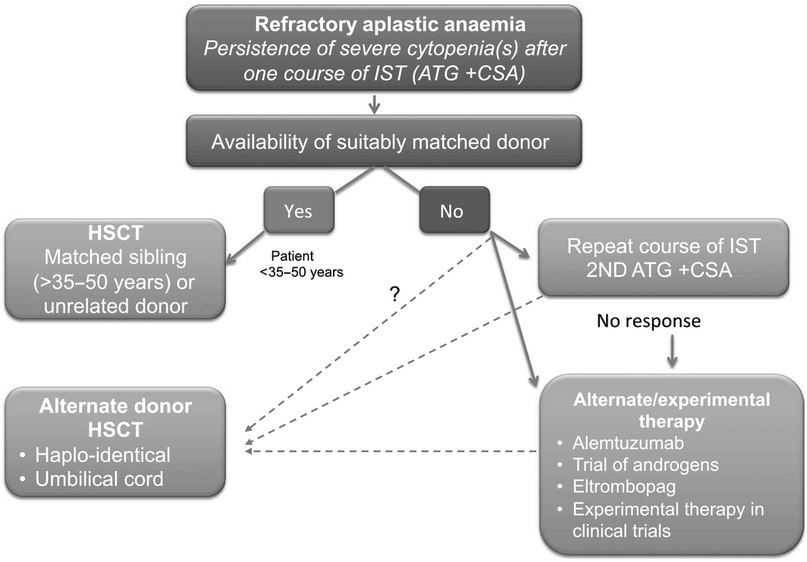
- Иммуносупрессивная терапия 1 линии — это сочетание лошадиного ATG и циклоспорина для пациентов с нетяжелой АА, тяжелых или очень тяжелых пациентов с АА, у которых отсутствует подходящий родственный донор, а также тяжелых или очень тяжелых пациентов с АА старше 35–50 лет. Второй курс ATG может быть проведен после отсутствия ответа на первый курс или после рецидива после первого курса. При отсутствии ответа на второй курс АА считается рефрактерной и проводится альтернативная терапия при помощи алемтузумаба, элтромбопага или ТСК.
Также необходима поддерживающая терапия при помощи гемотрансфузии. Единого целевого значения концентрации гемоглобина не существует, и оно должно быть установлен индивидуально. Для снижения риска иммунизации следует учитывать фенотип Rh и Kell. Пациентам с АА, получающим активное лечение и находящимся в стабильном состоянии, следует назначать профилактические переливания тромбоцитов, пороговая концентрация тромбоцитов составляет 10×109/л. У пациентов, имеющих факторы риска кровотечения, число тромбоцитов должно составлять 20×109/л. Регулярные профилактические переливания тромбоцитов не рекомендуются для стабильных пациентов с АА, не находящихся на активном лечении в данный момент. У пациентов с апластической анемией при регулярной поддержке переливания РБК будет развиваться перегрузка тканевого железа. Сывороточный ферритин остается наиболее широко используемым показателем для оценки перегрузки железом. Магнитно-резонансная томография может определять содержание железа количественно и является хорошим дополнением к лабораторным методам мониторинга [4].
- Harrison’s Hematology and Oncology, 3rd Edition logy and Oncology, 3rd Edition. P.135-140
- Current concepts in the pathophysiology and treatment of aplastic anemia. Neal S. Young, Rodrigo T. Calado, Phillip Scheinberg. Blood Oct 2006, 108 (8) 2509-2519; DOI: 10.1182/blood-2006-03-01077
- Burkhardt R. et al. Changes in trabecular bone, hematopoiesis and bone marrow vessels in aplastic anemia, primary osteoporosis, and old age: a comparative histomorphometric study //Bone. – 1987. – Т. 8. – №. 3. – С. 157-164.
- Killick, S. B., Bown, N., Cavenagh, J., Dokal, I., Foukaneli, T., Hill, A., Hillmen, P., Ireland, R., Kulasekararaj, A., Mufti, G., Snowden, J. A., Samarasinghe, S., Wood, A., Marsh, J. C. W. and the British Society for Standards in Haematology (2016), Guidelines for the diagnosis and management of adult aplastic anaemia. Br J Haematol, 172: 187–2016
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
