В мышцах функции аналогичные гемоглобину выполняет белок
71. В крови содержится: 4.5 – 5.0*1012/л эритроцитов у мужчин и 4.0-4.5 *1013 /л эритроцитов у женщин.
72. Абсолютный эритроцитоз наблюдается у жителей высоких широт вследствие хронической гипоксии.
73. У взрослого человека содержится разновидность гемоглобина НвА.
74. В норме цветной показатель составляет 0,8-1.0.
75. Гемоглобин образуется в костном мозге.
76. Из соединений гемоглобина патологическим является карбоксигемоглобин.
77. В мышцах содержится миоглобин, выполняющий функции, аналогичные гемоглобину
78. Гемолизом называется разрушение оболочки эритроцитов, сопровождающееся выходом гемоглобина в плазму крови.
79. Осмотический гемолиз эритроцитов возникает при уменьшении осмотического давления плазмы крови.
80. Лейкопения – это снижение количества лейкоцитов.
81. В норме у человека (без учета пола содержится) 4.0 – 9.0 *109 л. лейкоцитов.
82. В красном костном мозге образуются эритроциты, лейкоциты, тромбоциты.
83. Т-лимфоциты обеспечивают клеточный иммунитет.
84. Роль B-зависимых лимфоцитов – создание гуморального иммунитета.
85. Реактивный (истинный) лейкоцитоз возникает при воспалительных процессах.
86. Иммунитет это способ защиты организма от микробов, вирусов, паразитов и генетически чуждых клеток и веществ.
87. К специфическим механизмам иммунитета относится образование антител или иммуноглобулинов.
88. К неспецифическим механизмам защиты относится фагоцитоз.
89. Для клинициста при анализе изменений крови более важно изменение взаимоотношений в лейкоцитарной формуле.
90. Выработку красных клеток крови стимулируют эритропоэтины.
91. Выработку белых клеток крови стимулируют лейкопоэтины.
92. Диаметр эритроцитов у человека – 7-8 мк.
93. Содержание моноцитов в крови здорового человека составляет 4 – 8%.
94. Основными фагоцитами крови являются нейтрофилы.
95. Антитела вырабатывают лимфоциты.
96. Функция эозинофилов заключается в детоксикации продуктов, образующихся при аллергических реакциях.
97. Продуцируют гепарин базофилы.
98. В литре крови в норме содержится 2 -3 *1011/л тромбоцитов.
99. В крови здорового мужчины количество гемоглобина составляет 130-160 г/л.
100. В крови эритроцит живет 100-120 дней.
101. Продолжительность жизни гранулоцитов в крови – 1-15 дней.
102. Продолжительность жизни тромбоцитов – до 5 дней.
103. Костному мозгу не свойственна функция разрушение эритроцитов (эритродиерез).
104. Один грамм гемоглобина связывает 1,34-1,36 мл кислорода.
105. Киллерами являются Т –лимфоциты.
106. Дифференцировку клеток костного мозга в сторону эритроцитов направляет эритропоэтин.
107. Эритропоэтин вырабатывается в юкстагломерулярном аппарате почек.
108. Внутренний фактор Кастла необходим для всасывания витамина В-12 в кишечнике.
109. Процент палочкоядерных нейтрофилов в лейкоцитарной формуле в норме составляет 3-5%.
110. Содержание лимфоцитов в крови здорового человека составляет 20-40 %.
111. Подсчет лейкоцитов после обеда покажет увеличение их числа в вашей крови.
112. Существуют суточные колебания количества клеток в крови.
113. Содержание нейтрофилов в крови здорового человека составляет 47 – 72%.
114. Содержание эозинофилов в крови здорового человека составляет 1-5%.
115. Лейкоциты осуществляют .защитные реакции.
116. Нейтрофилы участвуют в фагоцитозе и разрушении микроорганизмов.
117. Функция лимфоцитов заключается в распознавании антигенов и выработке иммуноглобулинов (антител).
118. Процентное соотношение отдельных форм лейкоцитов называется лейкоцитарной формулой.
119. Повышенное содержание лейкоцитов в периферической крови называется лейкоцитозом.
120. Лимфоциты играют важную роль в процессах иммунитета.
121. Незернистые лейкоциты, способные к амебоидному движению и фагоцитозу, называются моноцитами.
122. Зернистые лейкоциты, обладающие фагоцитарной активностью и свойством связывать токсины, называются эозинофилами.
123. Для подсчета эритроцитов в счетной камере Горяева кровь разводят 3% раствором хлористого натрия.
124. Для подсчета лейкоцитов в счетной камере Горяева кровь разводят 5% раствором уксусной кислоты с метиленовой синькой.
125. Для определения СОЭ используют 5% раствор цитрата натрия.
126. Оксигемоглобин – это соединение гемоглобина с кислородом.
127. Карбогемоглобин – это соединение гемоглобина с углекислым газом.
128. Карбоксигемоглобин – соединение гемоглобина с угарным газом.
129. Метгемоглобин – это окисленный гемоглобин, в котором железо трехвалентно.
130. Цветной показатель – это показатель степени насыщения эритроцитов гемоглобином.
131. Цветной показатель в норме равен 0,8-1,0.
132. Анемия – это пониженное содержание в крови гемоглобина и эритроцитов (и, значит, ее кислородной емкости).
133. К макрофагам относятся моноциты.
134. К микрофагам относятся нейтрофилы, эозинофилы, базофилы.
135. Продолжительность жизни нейтрофилов – от нескольких часов до нескольких суток.
136. Продолжительность жизни лимфоцитов – более 20 лет.
137. Продолжительность жизни тромбоцитов – 5-11 суток.
138. Функции лимфатических узлов – барьерная и образование В- лимфоцитов.
139. Форма эритроцита – двояковогнутый диск.
140. Нормальный по форме эритроцит называется дискоцитом.
141. Снижение среднего диаметра эритроцитов ниже 6,0 мкм называется микроцитозом.
142. Двояковогнутая форма эритроцита позволяет всем молекулам Нв быть максимально приближенными к поверхности, иметь большую площадь клетки и высокую эластичность.
143. Днем эритроцитов в крови больше, чем ночью.
144. В артериальной крови преимущественно находится оксигемоглобин.
145. Валентность железа в метгемоглобине равна 3.
146. В периферической крови в норме содержатся ретикулоциты и эритроциты.
147. Средний процент ретикулоцитов в периферической крови взрослого человека в норме – 0-1 %.
148. Преимущественный путь разрушения эритроцитов – гемолиз в клетках ретикулоэндотелиальной системы.
149. Разрушение эритроцитов идет в печени, селезенке.
150. Белковый компонент гемоглобина, появляющегося в ходе эритродиереза, в дальнейшем подвергается гидролизу до аминокислот с использованием на энергетические и пластические цели.
151. Билирубиновые конъюгаты из просвета кишечника выводятся с калом и частично всасываются.
152. Т-лимфоциты дифференцируются в тимусе.
153. В- лимфоциты дифференцируются в скоплениях лимфоидной ткани.
154. Увеличение процента молодых форм лейкоцитов называют сдвигом лейкоцитарной формулы влево.
155. За 1 секунду в организме человека разрушаются сотни тысяч эритроцитов.
156. Рецепторы функциональной системы, обеспечивающей постоянство эритроцитов крови, и воспринимающие концентрацию кислорода, расположены в дуге аорты и синокаротидной зоне.
157. Воспринимающее звено функциональной системы которая поддерживает постоянства числа эритроцитов в крови, представлено специфическими хеморецепторами.
158. Нервные центры, регулирующие процессы кроветворения, находятся в гипоталамусе.
159. Внутренний фактор Кастла вырабатывается в желудке. Он способствует всасыванию витамина В12, необходимого для нормального процесса эритропоэза.
160. При тяжелой физической работы количество лейкоцитов в периферической крови увеличивается, потому что они выходят из депо.
161. Эритропоэтины являются специфическими регуляторами эритропоэза. Они образуются в ЮГА почки.
Дано определение миоглобина и описаны его структура и функции. Приведены данные о концентрации миоглобина в скелетных мышцах человека и животных, а также в плазме крови человека. Приведен сравнительный анализ гемоглобина и миоглобина.
Определение
Миоглобин (Mb) – белок, который связывает кислород в скелетных мышцах и миокарде (сердечной мышце) почти всех млекопитающих, в том числе и человека. Молекулярная масса миоглобина – 17,2 кДа (1Да=1,66 10-24 г.).
Структура миоглобина
Первичная структура миоглобина представлена одной полипептидной цепью, состоящей из 146-154 аминокислотных остатков. Вторичная структура — α-спираль. Третичная структура миоглобина представлена свернутой в шар α-спиралью (глобулой) и небелковой частью – гемом (рис.1). Присутствие гема придает миоглобину красный цвет. В геме имеется железо, которое связывает кислород. В 1957 году Джон Кендрю посредством рентгеновской кристаллографии впервые определил пространственное расположение полипептидной цепи в молекуле белка миоглобина, а в 1959 году установил его детальное строение, подтвердив наличие в нём α-спиралей, которое еще в 1951 году предсказал Лайнус Полинг.
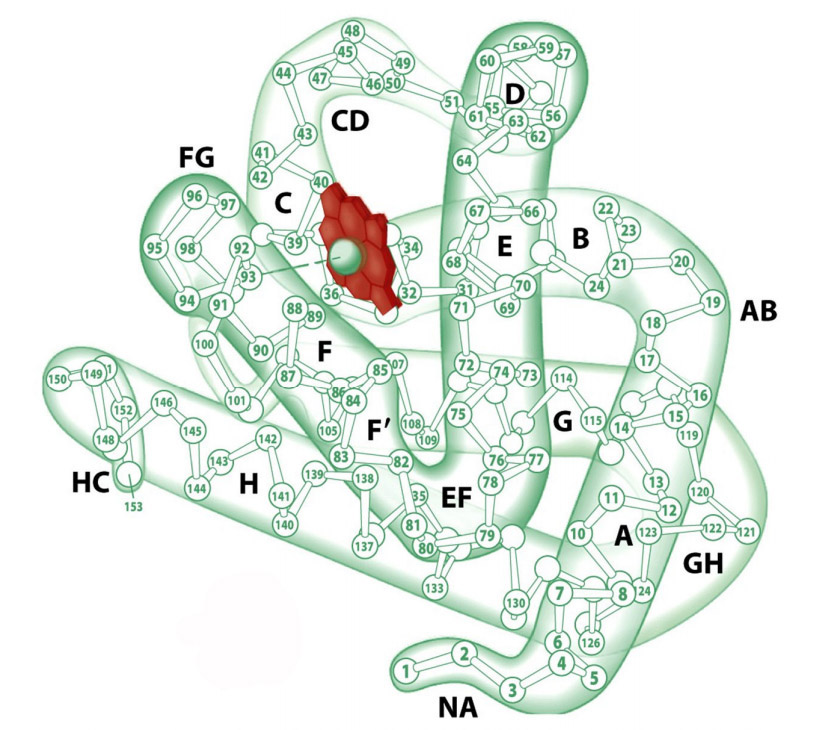
Рис.1. Структура миоглобина. Красным цветом выделен гем (illustration I. Geis)
Функции миоглобина
В мышечных волокнах миоглобин выполняет следующие функции:
- Депонирует кислород. Мышцы, поглощая кислород из крови, накапливают его в мышечных волокнах в вида оксимиоглобина. Таким образом создается резерв миоглобина, который используется для усиления окислительных процессов при тяжелой физической работе. Депонирование происходит в период покоя, расход в момент сокращения мышц. Однако емкость этого депо невелика. Оно может обеспечить снабжение кислородом скелетные мышцы в течение 8 с, а миокард в течение 15-20 с (Стародуб Р.Ф., Коробов В.Н., Назаренко В.И., 1992).
- Переносит кислород от плазматической мембраны к митохондриям. Тем самым обеспечивая функционирование тканевого дыхания.
- Связывает и освобождает оксид азота (NO) – одну из главных сигнальных молекул, играющих критическую роль в контроле поглощения кислорода, вазодилятации (расширения) сосудов и защиты мышечных волокон от активных форм кислорода (Кулева Н.В., Красовская И.Е., 2016).
Более подробно строение и функции мышц описаны в моих книгах
Концентрация миоглобина в мышечных волокнах
В мышечных волокнах скелетных мышц человека концентрация миоглобина составляет 0,4-0,5 мM (0,25 мг на 1 г ткани). Миоглобин присутствует во всех типах мышечных волокон, однако в разных концентрациях. В мышечных волокнах типа I его концентрация в 1,5 раза выше, чем в мышечных волокнах типа IIB. Именно поэтому мышечные волокна типа I имеют более красную окраску по сравнению с мышечными волокнами типа II. У морских млекопитающих концентрация миоглобина в мышечных волокнах может достигать 3,8 мM. Установлена значительная корреляция между концентрацией миоглобина в мышцах морских животных и глубиной ныряния. Установлено также, что концентрация миоглобина в мышечных волокнах коррелирует с объемной плотностью митохондрий и плотностью кровеносных капилляров.
Концентрация миоглобина в крови
В обычных условиях концентрация миоглобина в крови настолько низка (100 нг/мл), что он не определяется лабораторными методами. Однако при сильных повреждениях мышечных волокон скелетных мышц (краш-синдроме, синдроме позиционной ишемии) миоглобин может попасть в кровь. Так как молекулы миоглобина достаточно крупные, они могут закупоривать канальцы почек и приводить к их некрозу. В результате возникает острая почечная недостаточность и тканевая гипоксия. Это может привести к смерти человека.
При тяжелых силовых и аэробных тренировках (например при марафонском беге), также происходит частичное повреждение мышечных волокон скелетных мышц и миоглобин поступает в кровь.
При остром инфаркте миокарда концентрация миоглобина в крови повышается через 2-4 часа. Поэтому его относят к неспецифическим маркерам этого заболевания (Тереньев А.А., 2016).
Гемоглобин и миоглобин
Миоглобин похож на гемоглобин (Hb) – кислородсвязывающий белок в эритроцитах крови. Гемоглобин осуществляет транспорт кислорода от легких к тканям (в том числе и мышцам), а миоглобин – депонирование и транспорт кислорода внутри мышечных волокон. Структура гемоглобина более сложная, чем миоглобина. Молекула гемоглобина состоит из четырех полипептидных цепочек и гема, а молекула миоглобина – из одной полипепдиной цепочки и гема. Молекулярная масса гемоглобина человека 66,8 кДа. Миоглобин человека обладает большим сродством к кислороду, чем гемоглобин, и способен связывать до 14% от общего количества кислорода в организме.
Литература
- Кулева Н.В., Красовская И.Е. Новая роль миоглобина в функционировании сердечной и скелетной мышц // Молекулярная биофизика, 2016.– Т. 61., Вып. 5.– С. 861-864.
- Стародуб Р.Ф., Коробов В.Н., Назаренко В.И. Миоглобин: структура, свойства, синтез и биологическая роль.– Киев: Наукова думка, 1992.– 281 с.
- Терентьев А.В. Биохимия мышечной ткани: Учебное пособие.– М.: ФГБОУ ВО РНИМУ им. Н.И.Пирогова Минздрава России, 2019.– 2019 с.
С уважением, А.В. Самсонова
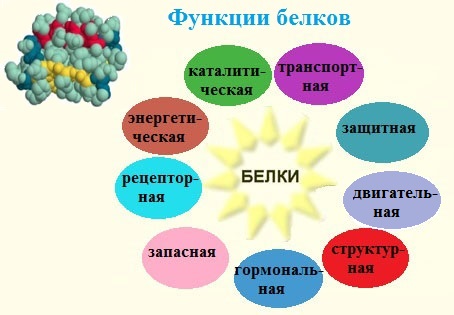
Функции белков в природе универсальны. Белки входят в состав всех живых организмов. Мышцы, кости, покровные ткани, внутренние органы, хрящи, шерсть, кровь — все это белковые вещества.
Растения синтезируют белки из углекислого газа и воды за счет фотосинтеза. Животные организмы получают, в основном, готовые аминокислоты с пищей и на их базе строят белки своего организма.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
Видеофильм «Функции белков»
Разнообразные функции белков определяются a-аминокислотным составом и строением их высокоорганизованных макромолекул.

1. Каталитическая (ферментативная) функция
Каталитическая функция — одна из основных функций белков. Абсолютно все биохимические процессы в организме протекают в присутствии катализаторов – ферментов. Все известные ферменты представляют собой белковые молекулы.
Белки – это очень мощные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой фермент.
В настоящее время известно свыше 2000 различных ферментов, которые являются биологическими катализаторами.
Например, фермент пепсин расщепляет белки в процессе пищеварения.
Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК.
2. Транспортная функция
Некоторые белки способны присоединять и переносить (транспортировать) различные вещества по крови от одного органа к другому и в пределах клетки.
Белки транспортируют липиды (липопротеиды), углеводы (гликопротеиды), ионы металлов (глобулины), кислород и углекислый газ (гемоглобин), некоторые витамины, гормоны и др.
Например, альбумины крови транспортируют липиды и высшие жирные кислоты (ВЖК), лекарственные вещества, билирубин.
Белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
Белок миоглобин запасает кислород в мышцах.
Специфические белки-переносчики обеспечивают проникновение минеральных веществ и витаминов через мембраны клеток и субклеточных структур.
3. Защитная функция
Защитную функцию выполняют специфические белки (антитела — иммуноглобулины), которые вырабатываются иммунной системой организма. Они обеспечивают физическую, химическую и иммунную защиту организма путем связывания и обезвреживания веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Например, белок плазмы крови фибриноген участвует в свертывании крови (образовывает сгусток). Это защищает организм от потери крови при ранениях.
Альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови.
Антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки. Интерфероны — универсальные противовирусные белки.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
4. Сократительная (двигательная) функция
Важным признаком жизни является подвижность, в основе которой лежит данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных сокращений к этой функции относят изменение форм клеток и субклеточных частиц.
B результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
5. Структурная функция
Структурная функция — одна из важнейших функций белков. Белки играют большую роль в формировании всех клеточных структур.
Белки – это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей, эластин стенок кровеносных сосудов, фиброин шелка и др.) выполняют почти исключительно структурную функцию.
Кератин синтезируется кожей. Волосы и ногти – это производные кожи.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
6. Гормональная (регуляторная) функция
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Интересно знать!
В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
7. Питательная (запасная) функция
Питательная функция осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
8. Рецепторная (сигнальная) функция
Некоторые белки (белки-рецепторы), встроенные в клеточную мембрану, способны изменять свою структуру под воздействием внешней среды. Так происходит прием сигналов извне и передача информации в клетку.
Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином.
Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
9. Энергетическая функция
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке (после их гидролиза). Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Белки
