В организме животных молекула кислорода не связывается с гемоглобином
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & C Chothia (1976), “Structural patterns in globular proteins”, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Источник
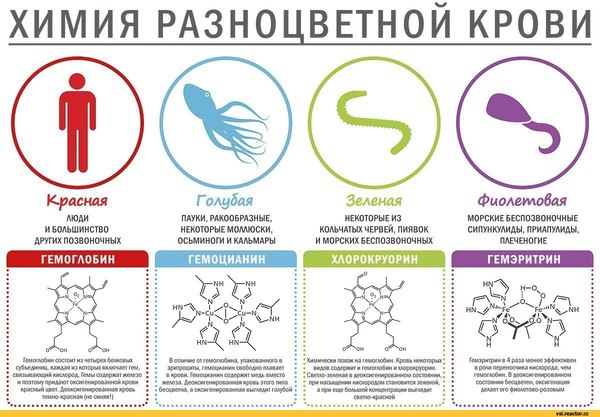
 æèâûõ îðãàíèçìàõ ìåäü âïåðâûå áûëà îáíàðóæåíà â 1808 ãîäó èçâåñòíûì ôðàíöóçñêèì õèìèêîì Ëóè Âîêëåíîì âûäàþùèìñÿ àíàëèòèêîì ñâîåãî âðåìåíè. Îí ïðîâåë ìíîæåñòâî èññëåäîâàíèé ðàçëè÷íûõ âåùåñòâ è ñ÷èòàåòñÿ îäíèì èç îñíîâîïîëîæíèêîâ õèìè÷åñêîãî àíàëèçà. Ïîçæå, â 1834 ãîäó, áûëî óñòàíîâëåíî ñîäåðæàíèå ìåäè ó ðÿäà áåñïîçâîíî÷íûõ æèâîòíûõ. Òî÷íîå ìåñòîíàõîæäåíèå åå ãåìîëèìôà, êîòîðàÿ èìååò ó íèõ ãîëóáóþ îêðàñêó. Ýòî îòêðûòèå ïðèíàäëåæèò èòàëüÿíñêîìó èññëåäîâàòåëþ Á. Áèçèî. Ãîëóáîé, à èíîãäà äàæå ñèíèé öâåò êðîâè ýòèõ æèâîòíûõ ïðèäàåòñÿ èîíîì ìåäè. Âñïîìíèì: ìíîãèå ñîåäèíåíèÿ ýòîãî ýëåìåíòà èìåþò ãîëóáîé öâåò, íàïðèìåð ìåäíûé êóïîðîñ.
Åùå â 1913 ãîäó ó÷åíèê Â. È. Âåðíàäñêîãî èçâåñòíûé ðóññêèé ãåîëîã è áèîãåîõèìèê ß. Â. Ñàìîéëîâ âûñêàçàë èäåþ îá ýâîëþöèè íå òîëüêî ñêåëåòà îðãàíèçìîâ, íî è êðîâè, ãäå ôóíêöèþ æåëåçà íà ðàçíûõ ñòàäèÿõ ðàçâèòèÿ ìîãëè âûïîëíÿòü òàêèå ìåòàëëû, êàê ìåäü èëè âàíàäèé.  ñàìîì äåëå, íå òîëüêî æåëåçî è ìåäü, íî è âàíàäèé, à òàêæå õðîì, ìàðãàíåö, êîáàëüò, íèêåëü, öèíê ïðèíàäëåæàò ê ýëåìåíòàì ïåðâîé ïåðåõîäíîé ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû. Ýòî ñîñåäè ñî ñõîäíûìè ñâîéñòâàìè. Èìåííî ýòè ñâîéñòâà â òîé èëè èíîé ñòåïåíè è îïðåäåëÿþò ðîëü ïåðå÷èñëåííûõ ìåòàëëîâ â áèîëîãè÷åñêèõ ïðîöåññàõ. Òàê, èîí ìåäè ïî ñðàâíåíèþ ñ èîíàìè äðóãèõ ìåòàëëîâ àêòèâíåå ðåàãèðóåò ñ àìèíîêèñëîòàìè è áåëêàìè, îáðàçóÿ óñòîé÷èâûå êîìïëåêñû, êîòîðûå òðóäíî ðàçðóøèòü. È âîîáùå ìåäü îäèí èç ñàìûõ ðàçíîñòîðîííèõ êàòàëèçàòîðîâ.  ñî÷åòàíèè ñ áåëêàìè åå àêòèâèðóþùåå äåéñòâèå óñèëèâàåòñÿ è ïðèîáðåòàåò ñïåöèôè÷íîñòü, ÷òî òàê âàæíî äëÿ ôåðìåíòîâ. Íàêîíåö, ìåäü ëåãêî ïåðåõîäèò èç îäíîãî âàëåíòíîãî ñîñòîÿíèÿ â äðóãîå. Âñå ýòè ñâîéñòâà ÿâëÿþòñÿ îáùèìè ó ìåäè è ó æåëåçà. Íî åñòü îäíî âàæíîå îáñòîÿòåëüñòâî: ñîåäèíåíèÿ îäíîâàëåíòíîé ìåäè ëåãêî îêèñëÿþòñÿ êèñëîðîäîì âîçäóõà. Ïîýòîìó ìåäüñîäåðæàùèå ôåðìåíòû, êàòàëèçèðóþùèå â îðãàíèçìå ïðîöåññû îêèñëåíèÿ, ñàìè áûñòðî îêèñëÿþòñÿ, â ðåçóëüòàòå ÷åãî èõ ôóíêöèÿ âîññòàíàâëèâàåòñÿ.
Íå âûäåðæàâ ñîñòÿçàíèÿ ñ æåëåçîì â êà÷åñòâå ïåðåíîñ÷èêà êèñëîðîäà â êðîâè âûñøèõ æèâîòíûõ, ìåäü âñå æå îñòàëàñü íåçàìåíèìîé ïðè êðîâåòâîðåíèè. Åñëè ïðîñëåäèòü ïóòü ýòîãî ìåòàëëà â îðãàíèçìå, òî ìû óâèäèì, ÷òî ïðåæäå âñåãî îí ñâÿçûâàåòñÿ ñ áåëêîì ñûâîðîòêè êðîâè àëüáóìèíîì. Çàòåì ìåäü ïåðåõîäèò â ïå÷åíü è îòòóäà ñíîâà âîçâðàùàåòñÿ â ñûâîðîòêó íà ñåé ðàç â ñîñòàâå ãîëóáîãî áåëêà öåðóëîïëàçìèíà, èãðàþùåãî ãëàâíóþ ðîëü â åå õðàíåíèè è, òðàíñïîðòå ó âûñøèõ æèâîòíûõ.
Ñåðîå âåùåñòâî ìîçãà èç ïðàâîãî è ëåâîãî åãî ïîëóøàðèé ñîäåðæèò ðàçíîå êîëè÷åñòâî ìåäè. À âåäü èçâåñòíî, ÷òî ïîëóøàðèÿ ðàçâèòû íåîäèíàêîâî. Ó ÷åëîâåêà ëåâîå ïîëóøàðèå áîëåå àêòèâíî è ñîäåðæèò áîëüøå ðàçëè÷íûõ áèîëîãè÷åñêè àêòèâíûõ ìåòàëëîâ. Áîëüøå âñåãî ìåäè íàõîäèòñÿ â ïîäêîðêîâûõ îáðàçîâàíèÿõ, ñâÿçàííûõ ñ îñóùåñòâëåíèåì äâèãàòåëüíûõ ôóíêöèé. Óñòàíîâëåíî, ÷òî ïðàâîå ïîëóøàðèå ãîëîâíîãî ìîçãà óïðàâëÿåò ëåâîé ïîëîâèíîé íàøåãî òåëà, à ëåâîå ïðàâîé. Èìåííî ïðàâîå ïîëóøàðèå îòâåòñòâåííî çà êîîðäèíàöèþ è ïðîñòðàíñòâåííîå ïåðåìåùåíèå, ëåâîå æå êîíòðîëèðóåò ÿçûê è ðå÷ü. Íî áûâàåò, ÷òî ïðàâîå ïîëóøàðèå ðàçâèâàåòñÿ áûñòðåå ëåâîãî è ñòàíîâèòñÿ áîëåå àêòèâíûì, âûïîëíÿÿ â íåêîòîðîé ñòåïåíè ôóíêöèè è ëåâîãî ïîëóøàðèÿ.  ýòîì ñëó÷àå ÷åëîâåê ñòàíîâèòñÿ ëåâøîé. Ýòî ÿâëåíèå ñâÿçàíî ñ íåêîòîðîé ãîðìîíàëüíîé àíîìàëèåé.

Ñëîâîñî÷åòàíèå «ãîëóáàÿ êðîâü» ïîÿâèëîñü â ëåêñèêîíå íàñåëåíèÿ Åâðîïû îòíîñèòåëüíî íåäàâíî, â XVIII âåêå. Ñ÷èòàåòñÿ, ÷òî ýòî âûðàæåíèå âîçíèêëî â èñïàíñêîé ïðîâèíöèè Êàñòèëèÿ.
Èìåííî òàì óòîí÷åííûå ãðàíäû ãîðäî äåìîíñòðèðîâàëè áëåäíóþ êîæó ñ ïðîñòóïàþùèìè ñèíåâàòûìè ïðîæèëêàìè, ÿâëÿþùóþñÿ äîêàçàòåëüñòâîì òîãî, ÷òî èõ êðîâü íå îñêâåðíåíà ïðèìåñÿìè «ãðÿçíîé» ìàâðèòàíñêîé.
À ñóùåñòâóåò ëè îíà?
Äëÿ îáåñïå÷åíèÿ æèçíåäåÿòåëüíîñòè îðãàíèçì äîëæåí ïîòðåáëÿòü êèñëîðîä è âûäåëÿòü óãëåêèñëûé ãàç. Îäíà èç ãëàâíûõ ôóíêöèé êðîâè – ïåðåíîñ êèñëîðîäà è óãëåêèñëîãî ãàçà. Äëÿ ýòîãî «ïðèñïîñîáëåíû» ñïåöèàëüíûå ýëåìåíòû êðîâè – äûõàòåëüíûå ïèãìåíòû, êîòîðûå ñîäåðæàò èîíû ìåòàëëà, ñïîñîáíûå ñâÿçûâàòü ìîëåêóëû êèñëîðîäà è ïðè íåîáõîäèìîñòè îòäàâàòü èõ. Ó áîëüøèíñòâà æèâîòíûõ äûõàòåëüíûì ïèãìåíòîì êðîâè ÿâëÿåòñÿ ãåìîãëîáèí, â ñîñòàâ êîòîðîãî âõîäÿò èîíû äâóõâàëåíòíîãî æåëåçà. Èìåííî áëàãîäàðÿ ãåìîãëîáèíó íàøà êðîâü êðàñíàÿ.
Ãîëóáóþ êðîâü ó íåêîòîðûõ ïîçâîíî÷íûõ âïåðâûå îïèñàë çíàìåíèòûé ãîëëàíäñêèé íàòóðàëèñò ßí Ñâàììåðäàì åùå â 1669 ãîäó, îäíàêî îáúÿñíèòü ïðèðîäó ýòîãî ÿâëåíèÿ åìó íå óäàëîñü. Òîëüêî ÷åðåç äâà ñòîëåòèÿ, â 1878 ãîäó ôðàíöóçñêèé ó÷åíûé Ë. Ôðåäåðèêî èçó÷èë âåùåñòâî, êîòîðîå ïðèäàâàëî êðîâè ìîëëþñêîâ ãîëóáîé öâåò, è ïî àíàëîãèè ñ ãåìîãëîáèíîì íàçâàë åãî ãåìîöèàíèíîì, îò ñëîâ «òåìà» – «êðîâü» è «öèàíîñ» – «ñèíèé».
Ê ýòîìó âðåìåíè áûëî âûÿñíåíî, ÷òî íîñèòåëÿìè ãîëóáîé êðîâè ÿâëÿþòñÿ ïàóêè, ñêîðïèîíû è íåêîòîðûå ìîëëþñêè. Òàêîé öâåò ïðèäàâàëè íàõîäÿùèåñÿ â íåé èîíû ìåäè. Â ãåìîöèàíèíå îäíà ìîëåêóëà êèñëîðîäà ñâÿçûâàåòñÿ ñ äâóìÿ àòîìàìè ìåäè. Ïðè òàêèõ óñëîâèÿõ è ïðîèñõîäèò ïîñèíåíèå êðîâè.
Ñ òî÷êè çðåíèÿ ñíàáæåíèÿ îðãàíèçìà êèñëîðîäîì ãåìîöèàíèí çíà÷èòåëüíî óñòóïàåò ãåìîãëîáèíó, â êîòîðîì ïåðåíîñ îñóùåñòâëÿåòñÿ æåëåçîì. Ãåìîãëîáèí ñ ýòîé âàæíåéøåé äëÿ æèçíåäåÿòåëüíîñòè îðãàíèçìà çàäà÷åé ñïðàâëÿåòñÿ â ïÿòü ðàç ëó÷øå.
Íî è îò ìåäè, òåì íå ìåíåå, ïðèðîäà íå îòêàçàëàñü ïîëíîñòüþ, à äëÿ íåêîòîðûõ æèâîòíûõ è ðàñòåíèé ñäåëàëà åå ñîâåðøåííî íåçàìåíèìîé. È âîò ÷òî èíòåðåñíî. Îêàçûâàåòñÿ, ðîäñòâåííûå ãðóïïû æèâûõ îðãàíèçìîâ ìîãóò èìåòü ðàçíóþ êðîâü, à ïðîèçîøëè îíè âðîäå áû äðóã îò äðóãà. Íàïðèìåð, ó ìîëëþñêîâ êðîâü áûâàåò êðàñíîé, ãîëóáîé, êîðè÷íåâîé, ñ ðàçíûìè ìåòàëëàìè. Âûõîäèò, ÷òî ñîñòàâ êðîâè íå ñòîëü óæ âàæåí äëÿ æèâûõ îðãàíèçìîâ.
Íåîáû÷íûå ëþäè
 XX âåêå ïðîèñõîæäåíèåì ãîëóáîé êðîâè ñíîâà çàèíòåðåñîâàëèñü ó÷åíûå. Îíè âûäâèíóëè ãèïîòåçó, ÷òî ãîëóáàÿ êðîâü ñóùåñòâóåò, è ëþäè, â êðîâè êîòîðûõ âìåñòî æåëåçà ïðåîáëàäàåò ìåäü -èõ íàçâàëè «êèàíåòèêàìè», – æèëè íà íàøåé ïëàíåòå âñåãäà. Ïðàâäà, íà ñàìîì äåëå êðîâü ñ ïðåîáëàäàíèåì ìåäè öâåò èìååò íå ãîëóáîé, à ëèëîâûé ñ ñèíåâàòûì îòòåíêîì.

Èññëåäîâàòåëè íåïîçíàííîãî ñ÷èòàþò, ÷òî êèàíåòèêè áîëåå æèâó÷è è æèçíåñïîñîáíû ïî ñðàâíåíèþ ñ îáû÷íûìè ëþäüìè. Âî-ïåðâûõ, îíè ìåíåå ïîäâåðæåíû ðàçíîîáðàçíûì çàáîëåâàíèÿì êðîâè. Âî-âòîðûõ, èõ êðîâü îáëàäàåò ëó÷øåé ñâåðòûâàåìîñòüþ, è ëþáûå ðàíû, äàæå î÷åíü òÿæåëûå, íå ñîïðîâîæäàþòñÿ îáèëüíûì êðîâîòå÷åíèåì.
 êà÷åñòâå ïðèìåðà ïðèâîäÿòñÿ îïèñûâàåìûå â èñòîðè÷åñêîé õðîíèêå ñîáûòèÿ, êîãäà èçðàíåííûå ðûöàðè-êèàíåòèêè íå èñòåêàëè êðîâüþ è ïðîäîëæàëè óñïåøíî ñðàæàòüñÿ ñ ìàâðàìè.
Ïî ìíåíèþ íåêîòîðûõ èññëåäîâàòåëåé, êèàíåòèêè ïîÿâèëèñü íà Çåìëå íåñëó÷àéíî. Òàêèì îáðàçîì ïðèðîäà ïîäñòðàõîâûâàëàñü íà ñëó÷àé êàêîé-ëèáî ãëîáàëüíîé êàòàñòðîôû, êîòîðàÿ ìîæåò óíè÷òîæèòü áîëüøóþ ÷àñòü ÷åëîâå÷åñòâà. Îñòàâøèåñÿ â æèâûõ áîëåå æèçíåñòîéêèå ãîëóáîêðîâíûå ñìîãóò äàòü íà÷àëî åùå îäíîé, óæå íîâîé öèâèëèçàöèè.
Íî åñòü è äðóãîå îáúÿñíåíèå ïðîèñõîæäåíèÿ ãîëóáîêðîâíûõ ëþäåé: îíè ïîòîìêè ïðèøåëüöåâ èç äðóãèõ ïëàíåò.
Ïëàíåòà áîãîâ
Âñåëåííàÿ, â êîòîðîé ìû æèâåì, ìíîãîîáðàçíà. Äàæå â ïðåäåëàõ Ñîëíå÷íîé ñèñòåìû ïî ñïåêòðàëüíîìó èçëó÷åíèþ ïëàíåò óñòàíîâëåíî, ÷òî îíè îòëè÷àþòñÿ ïðåîáëàäàþùèìè â èõ ñòðîåíèè ýëåìåíòàìè. Ïîòîìó ìîæíî ïðåäïîëîæèòü, ÷òî ãäå-òî ðàñïðîñòðàíåííîãî íà íàøåé ïëàíåòå æåëåçà, èãðàþùåãî ñòîëü âàæíóþ ðîëü â æèçíåäåÿòåëüíîñòè âíóòðåííèõ îðãàíîâ îðãàíèçìîâ, î÷åíü ìàëî, à ìåäè – íàîáîðîò, î÷åíü ìíîãî. Åñòåñòâåííî, ÷òî òàì ýâîëþöèÿ æèâîòíîãî ìèðà ïîéäåò ïî ïóòè èñïîëüçîâàíèÿ äëÿ òðàíñïîðòà êèñëîðîäà íå æåëåçà, à ìåäè. È ëþäè è æèâîòíûå ýòîé ïëàíåòû áóäóò îáëàäàòü «àðèñòîêðàòè÷åñêîé», ãîëóáîé êðîâüþ.
Âåðñèÿ êðîâè áîãîâ íà îñíîâå ãåìîöèàíèíà (èëè äðóãèõ ñîåäèíåíèé ìåäè) äàåò òàêæå âîçìîæíîñòü ïî èíîìó âçãëÿíóòü íà íåêîòîðûå äàííûå ìèôîëîãèè. Âî-ïåðâûõ, ìåäü îáëàäàåò ñèëüíûìè àíòèáàêòåðèàëüíûìè ñâîéñòâàìè. Ìíîãèå íàðîäû ïðèïèñûâàþò ìåäè öåëåáíûå ñâîéñòâà. Íåïàëüöû, íàïðèìåð, ñ÷èòàþò ìåäü ñâÿùåííûì ìåòàëëîì, êîòîðûé ñïîñîáñòâóåò ñîñðåäîòî÷åíèþ ìûñëåé, óëó÷øàåò ïèùåâàðåíèå è ëå÷èò æåëóäî÷íî-êèøå÷íûå çàáîëåâàíèÿ (áîëüíûì äàþò ïèòü âîäó èç ñòàêàíà, â êîòîðîì ëåæàò íåñêîëüêî ìåäíûõ ìîíåò).  ñòàðèíó ìåäüþ ëå÷èëè ãëèñòíûå çàáîëåâàíèÿ, ýïèëåïñèþ, õîðåþ, ìàëîêðîâèå, ìåíèíãèò. Ìåäü ñïîñîáíà óáèâàòü ìèêðîáîâ; íàïðèìåð, ðàáîòíèêè ìåäíûõ çàâîäîâ íèêîãäà íå áîëåëè õîëåðîé.  òî æå âðåìÿ, íåäàâíî ó÷åíûå óíèâåðñèòåòà Øòàòà Îãàéî âûÿñíèëè, ÷òî ïåðåäîçèðîâêà æåëåçà â ïèùåâîé äèåòå ìîæåò ñïîñîáñòâîâàòü ñêëîííîñòè ê êèøå÷íûì èíôåêöèÿì. Òàêèì îáðàçîì, ïîâûøåííîå ñîäåðæàíèå ìåäè è ïîíèæåííîå ñîäåðæàíèå æåëåçà â ïèùå áîãîâ ïîçâîëÿëî èì óñèëèâàòü àíòèáàêòåðèàëüíûå ñâîéñòâà, êîòîðûìè èòàê îáëàäàëà èõ êðîâü áëàãîäàðÿ ìåäè â ñâîåì ñîñòàâå. Ýòî âïîëíå ìîãëî ïðåäîõðàíÿòü îò çåìíûõ èíôåêöèé è âíîñèòü ñâîþ ëåïòó â «áåññìåðòèå» áîãîâ. Ýôôåêòèâíà ìåäü, êàê îêàçûâàåòñÿ, è äëÿ ëå÷åíèÿ äðóãèõ áîëåçíåé.
Êóçíåöû, îïîÿñàííûå ìåäíîé ïðîâîëîêîé, íèêîãäà íå ñòðàäàëè ðàäèêóëèòàìè. Ïðè ðàäèêóëèòå êðàñíûå ìåäíûå ïÿòàêè óêðåïëÿþò ïëàñòûðåì íà êðåñòöå èëè êëàäóò íà ïîÿñíèöó è íàäåâàþò ïîÿñ èç ñîáà÷åé øåðñòè. Äëÿ ýòèõ æå öåëåé ìîæíî èñïîëüçîâàòü ìåäíûé êàíàòèê èëè àíòåííóþ ïðîâîëîêó, êîòîðóþ îáìàòûâàþò âîêðóã ñåáÿ. Äëÿ ëå÷åíèÿ áîëåé â ñóñòàâàõ, îòëîæåíèÿ ñîëåé èñïîëüçóþò ñòàðèííîå ñðåäñòâî â âèäå ìåäíîãî êîëüöà, êîòîðîå íîñÿò íà ïàëüöå íåñêîëüêî ìåñÿöåâ, áîëè ïðè ýòîì óìåíüøàþòñÿ, à ïîäâèæíîñòü â ñóñòàâàõ óâåëè÷èâàåòñÿ. Îñîáîé ïîïóëÿðíîñòüþ ïîëüçóþòñÿ ìåäíûå áðàñëåòû. Íî îíè ýôôåêòèâíû, åñëè ñîäåðæàíèå ìåäè â íèõ äîñòèãàåò 99%. Áðàñëåò íà ïðàâîé ðóêå ïîìîãàåò èçëå÷èòü èëè óñïîêîèòü ãîëîâíóþ áîëü, áåññîííèöó, ôèçè÷åñêóþ è óìñòâåííóþ óñòàëîñòü, ñàõàðíûé äèàáåò, èìïîòåíöèþ. Íà ëåâîé æå ðóêå íîøåíèå áðàñëåòà ðåêîìåíäóåòñÿ ïðè ïîâûøåííîì êðîâÿíîì äàâëåíèè, ãåìîððîå, ñåðäå÷íîé íåäîñòàòî÷íîñòè, òàõèêàðäèè. Âî âñåì ìèðå îöåíèëè áðàñëåòû èç ÷èñòîé ïåðóàíñêîé ìåäè
Âî-âòîðûõ, ãîëóáîé öâåò êðîâè ïðèäàåò ñîîòâåòñòâóþùèé îòòåíîê è öâåòó êîæè. È êàê òóò íå âñïîìíèòü «ãîëóáîêîæèõ» áîãîâ Èíäèè!..
Â-òðåòüèõ, â ïðèðîäå ìåäíûå ìåñòîðîæäåíèÿ ñîäåðæàò äîâîëüíî ìíîãî ñåðåáðà. Ñåðåáðî áóêâàëüíî ñîïðîâîæäàåò ìåäü ïî÷òè ïîâñþäó. Ýòî íàñòîëüêî ñèëüíî ïðîÿâëÿåòñÿ, ÷òî äàæå âåñîìàÿ ÷àñòü ñîâðåìåííîé äîáû÷è ñåðåáðà îñóùåñòâëÿåòñÿ ïîïóòíî ñ äîáû÷åé ìåäè, ïî÷òè ïÿòàÿ ÷àñòü âñåãî ñåðåáðà íûíå äîáûâàåòñÿ èç ìåäíûõ ìåñòîðîæäåíèé. Ñëåäîâàòåëüíî, íà ïëàíåòå áîãîâ òàêæå äîëæíî áûòü ìíîãî ñåðåáðà (õèìè÷åñêèå è ôèçè÷åñêèå çàêîíû âåäü äåéñòâóþò è òàì). Íî ñåðåáðî, òàêæå êàê è ìåäü, îáëàäàåò ñèëüíûì àíòèáàêòåðèàëüíûì äåéñòâèåì. «Ñåðåáðÿíàÿ âîäà» ýòî âçâåñü ìåëü÷àéøèõ ÷àñòèö ñåðåáðà â âîäå. Îíà îáðàçóåòñÿ ïðè õðàíåíèè âîäû â ñåðåáðÿíûõ ñîñóäàõ èëè ïðè êîíòàêòå âîäû ñ ñåðåáðÿíûìè èçäåëèÿìè. ×àñòèöû ñåðåáðà â òàêîé âîäå óæå ïðè êîíöåíòðàöèè 10-6 ìã/ë îáëàäàþò àíòèñåïòè÷åñêèìè ñâîéñòâàìè, ò. ê. ñåðåáðî ñïîñîáíî áëîêèðîâàòü ôåðìåíòíûå ñèñòåìû ìèêðîáîâ. Àëõèìèêè ñ÷èòàëè, ÷òî ñåðåáðî âõîäèò â ÷èñëî ñåìè ìåòàëëîâ, êîòîðûå îíè íàäåëÿëè öåëèòåëüíîé ñèëîé. Ñåðåáðî èñïîëüçîâàëè äëÿ ëå÷åíèÿ ýïèëåïñèè, íåâðàëãèè, õîëåðû, ãíîéíûõ ðàí.  âîäàõ ñâÿùåííîé èíäèéñêîé ðåêè Ãàíãà ïîâûøåíî ñîäåðæàíèå ñåðåáðà. Âûñîêèå äåçèíôèöèðóþùèå ñâîéñòâà ñåðåáðà ïðåâîñõîäÿò òàêèå æå ñâîéñòâà êàðáîëêè, ñóëåìû è õëîðíîé èçâåñòè. Ñïåöèàëüíî ïðèãîòîâëåííîå ñåðåáðî ïðèìåíÿåòñÿ ïðè ãîëîâíûõ áîëÿõ, ïîòåðå ãîëîñà ó ïåâöîâ, ñòðàõàõ, ãîëîâîêðóæåíèè. Åñëè íîñèòü ñåðåáðî íà ñåáå, òî ýòî óñïîêàèâàåò íåðâíóþ ñèñòåìó. À ýòî îïÿòü ðàáîòàåò íà «áåññìåðòèå» áîãîâ!.. Êðîìå òîãî, èçâåñòíî, ÷òî ïðè äëèòåëüíîì ââåäåíèè ñåðåáðà â îðãàíèçì êîæà ìîæåò ïðèîáðåñòè ãîëóáîé îòòåíîê, ÷òî â ñîâîêóïíîñòè ñ ãîëóáîé êðîâüþ áîãîâ íåèçáåæíî óñèëèâàåò ýôôåêò ãîëóáîé êîæè.
Çà âñå íàäî ïëàòèòü…
Îäíàêî ïðèëåòåâøèå íà Çåìëþ ñ «ìåäíîé» ïëàíåòû áîãè îñòàâèëè çåìëÿíàì íå òîëüêî íà÷àëüíûå íàâûêè â ìåòàëëóðãèè è ñòðåìëåíèå ê âåãåòàðèàíñòâó êàê ïóòü ê íðàâñòâåííîìó ñàìîñîâåðøåíñòâîâàíèþ.
Äëÿ äàëüíèõ ïîòîìêîâ áîãîâ, ó êîòîðûõ â òîé èëè èíîé ñòåïåíè ñîõðàíèëàñü ãîëóáàÿ êðîâü, ïîðîé õàðàêòåðåí èçáûòîê óãëåêèñëîãî ãàçà â êðîâè. Îí íå áûë ïîñòîÿííûì è ïðèâû÷íûì äëÿ èõ îðãàíèçìîâ.
Ýòî ïîäòâåðæäàåòñÿ ïîñòîÿííîé ïîòðåáíîñòüþ òàêèõ ëþäåé â ñïèðòíûõ íàïèòêàõ äëÿ êîìïåíñàöèè âðåäíîãî ãàçà. Ëåãåíäàðíóþ ñîìó, õìåëüíîé êâàñ è ìåä, ïèâî, äåâÿòü ñîðòîâ ñïèðòíûõ íàïèòêîâ, ñäåëàííûõ èç ìàèñà, áîãè äàëè àìåðèêàíñêèì èíäåéöàì è âíåñëè èõ â ñïèñîê æåðòâîïðèíîøåíèé! Áîãè äàæå íå ïðåíåáðåãàëè âèíîãðàäíûì âèíîì, â êîòîðîì ìíîãî æåëåçà. Âèäèìî, òðóäíà áûëà èõ æèçíü íà Çåìëå, ðàç ïîòðåáíîñòü â àëêîãîëå äëÿ êîìïåíñàöèè óãëåêèñëîãî ãàçà áûëà ñòîëü âåëèêà…
Âîîáùå, ñïèðòíûå íàïèòêè îáëàäàþò öåëûì ðÿäîì çàìå÷àòåëüíûõ ñâîéñòâ. Ýòè íàïèòêè ñîäåðæàò áîëüøîå êîëè÷åñòâî îðãàíè÷åñêèõ êèñëîò, áëàãîäàðÿ êîòîðûì îáëàäàþò è áóôåðíûìè ñâîéñòâàìè, íå ïîçâîëÿþùèìè ðÍ ñëèøêîì îïóñêàòüñÿ, è òåì ñàìûì ïðåïÿòñòâóþò óäåðæàíèþ â êðîâè èçëèøêîâ ÑÎ2. Íî îòìåòèì ñðàçó: ýòè ñâîéñòâà ïðèñóùè ïðåæäå âñåãî ñëàáîàëêîãîëüíûì íàïèòêàì! Êðåïêèå ñïèðòíûå íàïèòêè âåäóò ñåáÿ èíà÷å. È ìîæåò áûòü èìåííî ïîýòîìó ñ äðåâíåéøèõ âðåìåí èçâåñòíû ðåöåïòû ëèøü ñëàáîàëêîãîëüíûõ íàïèòêîâ, à êðåïêèå ñïèðòíûå íàïèòêè ïîÿâèëèñü ñðàâíèòåëüíî íåäàâíî (ëèøü â ïîñëåäíåå òûñÿ÷åëåòèå), – áîãàì íå íóæíà áûëà êðåïîñòü…
Îäíàêî âåðíåìñÿ ê äðóãèì ñâîéñòâàì àëêîãîëüíûõ íàïèòêîâ Ïüþùèå âèíî ëþäè ìåíüøå áîëåþò ãðèïïîì, ÷åì íåïüþùèå. Òàêèì îáðàçîì, âèíî îáåñïå÷èâàåò àíòèãðèïïîçíóþ ïðîôèëàêòèêó. Íàáëþäåíèÿ âðà÷åé ñâèäåòåëüñòâóþò, ÷òî ëþäè, ïüþùèå (óìåðåííî) âèíî, ðåæå íå âûõîäÿò íà ðàáîòó èç-çà èíôåêöèîííûõ çàáîëåâàíèé, ÷åì òå, êòî èñïîâåäóåò ïîëíîå àëêîãîëüíîå âîçäåðæàíèå. Ëàáîðàòîðíûå îïûòû ïîêàçàëè, ÷òî êðàñíîå âèíî, äàæå ðàçáàâëåííîå, óíè÷òîæàåò âèðóñ ïîëèîìèåëèòà. Óñòàíîâëåíî, ÷òî ñìåðòíîñòü îò êîðîíàðíîé íåäîñòàòî÷íîñòè îáðàòíî ïðîïîðöèîíàëüíà ïîòðåáëåíèþ àëêîãîëÿ. Íî ñðåäè àëêîãîëüíûõ íàïèòêîâ òîëüêî âèíî îáëàäàåò ÿðêî âûðàæåííûì ïðåâåíòèâíûì ýôôåêòîì â îòíîøåíèå ñåðäå÷íî-ñîñóäèñòûõ çàáîëåâàíèé. Èññëåäîâàíèÿ ïîêàçûâàþò, ÷òî ïðè óìåðåííîì óïîòðåáëåíèè âèíà, îò îäíîé äî ÷åòûðåõ ðþìîê â äåíü (1 ðþìêà âèíà åìêîñòüþ 100ìë è êðåïîñòüþ 12 ãðàäóñîâ ñîäåðæèò 10ã ñïèðòà), ñìåðòíîñòü âñëåäñòâèå êîðîíàðíîé íåäîñòàòî÷íîñòè ñíèæàåòñÿ äî 15-60% ïî ñðàâíåíèþ ñ ðèñêîì ïîäîáíîãî èñõîäà äëÿ ëþäåé, íå ïüþùèõ âèíà. Çàòî íå ïüþùèå âèíà ñîâñåì, ðàâíî êàê è ïüþùèå åãî ÷ðåçìåðíî (îò 60ã àëêîãîëÿ â äåíü è áîëåå), ïîäâåðãàþòñÿ î÷åíü âûñîêîìó ðèñêó ñìåðòåëüíîãî èñõîäà.
«Ñëèøêîì ãóñòàÿ» êðîâü, òî åñòü êðîâü ïîâûøåííîé âÿçêîñòè ñîçäàåò ñåðüåçíûå ïðåäïîñûëêè äëÿ îáðàçîâàíèÿ ñãóñòêîâ, ñïîñîáíûõ çàêóïîðèòü àðòåðèþ, èíà÷å ãîâîðÿ, ïðèâåñòè ê òðîìáîçó. Àëêîãîëü îáëàäàåò ñâîéñòâîì ðàçæèæàòü êðîâü. Ïîèñòèíå, ñîìà (ñïèðòíîé íàïèòîê áîãîâ) äàâàëà ëþäÿì çäîðîâüå, à áîãàì «áåññìåðòèå»!..
Источник
