Введение анемия и беременности
Введение
Анемия – патологическое состояние, характеризующееся уменьшением концентрации гемоглобина и, в подавляющем большинстве случаев, числа эритроцитов в единице объема крови. Частота анемии у беременных колеблется от 15 до 30% и, по данным Минздрава России, за последние 10 лет увеличилась в 6,3 раза, причем наиболее распространенной является железодефицитная анемия (ЖДА), на ее долю приходится около 90% от всех анемий [1]. Синдром ЖДА характеризуется ослаблением эритропоэза из-за дефицита железа вследствие несоответствия между поступлением и расходом (потреблением, потерей) железа, снижением наполнения гемоглобина железом с последующим уменьшением содержания гемоглобина в эритроците [2].
В соответствии с МКБ 10-го пересмотра учитывают следующие формы анемий, связанных с дефицитом железа:
D50 – железодефицитная анемия (асидеротическая, сидеропеническая, гипохромная);
D50.0 – железодефицитная анемия, связанная с хронической кровопотерей (хроническая постгеморрагическая анемия);
D50.1 – сидеропеническая дисфагия (синдромы Келли – Паттерсона и Пламмера – Винсона);
D50.8 – другие железодефицитные анемии;
D50.9 – железодефицитная анемия неуточненная.
ЖДА – нарушение, при котором снижается содержание железа в сыворотке крови, в костном мозге и депо, что приводит к нарушению образования гемоглобина, эритроцитов, возникновению анемий и трофических расстройств в тканях.
ЖДА занимают одно из ведущих мест в структуре экстрагенитальной заболеваемости беременных, т. к. во время беременности потребность в железе резко увеличивается вследствие высокой потребности в нем плаценты и плода, и возникает дисбаланс поступления и потребности необходимого микроэлемента. Согласно современным данным, дефицит железа в конце гестационного процесса развивается у всех без исключения беременных [2].
В организме человека содержится около 4 г железа: основная часть его (75%) входит в состав гемоглобина, меньшая часть входит в состав миоглобина (3,5%) и тканевых ферментов (0,5%), а также депонируется в печени и селезенке в виде ферритина и гемосидерина. Часть ферритина присутствует в плазме, а его концентрация служит индикатором запасов железа в организме [3].
Во время беременности потребность в железе неуклонно увеличивается (I триместр – на 1 мг/сут, II триместр – на 2 мг/сут, III триместр – на 3–5 мг/сут). Для выработки дополнительного железа используется 300–540 мг этого элемента. У большинства женщин к 28–30-недельному сроку физиологически протекающей беременности развивается анемия, связанная с неравномерным увеличением объема циркулирующей плазмы крови и объема эритроцитов. В результате показатель гематокрита снижается с 0,4 до 0,32, количество эритроцитов уменьшается с 4 до 3,5×1012/л, концентрация гемоглобина также снижается со 140 до 110 г/л (от I до III триместра). Подобные изменения картины красной крови, как правило, не отражаются на состоянии и самочувствии беременной. Истинная анемия беременных сопровождается типичной клинической картиной и оказывает влияние на течение беременности и родов. По сравнению с анемией, развившейся до беременности, анемия беременных протекает тяжелее, поскольку представляет собой осложнение, подобное гестозу. При наличии у женщины анемии, возникшей до наступления беременности, организм, как правило, успевает адаптироваться [3]. Суммарная потеря железа к окончанию беременности составляет примерно 1000–1200 мг. Процесс всасывания железа на протяжении беременности усиливается и составляет в I триместре 0,6–0,8 мг/сут, во II триместре – 2,8–3,0 мг/сут, в III триместре – до 3,5–4,0 мг/сут [4, 5]. Однако это не компенсирует повышенный расход элемента во время беременности. Более того, уровень депонированного железа у 100% беременных к концу гестационного периода снижается. Для восстановления запасов железа, потраченного в период беременности, родов и лактации, требуется не менее 2–3-х лет [6].
Биологическая значимость железа определяется его участием в тканевом дыхании. При дефиците железа у беременных возникает прогрессирующая гемическая гипоксия с последующим развитием вторичных метаболических расстройств. Поскольку при беременности потребление кислорода увеличивается на 15–33%, это усугубляет развитие гипоксии [4, 7].
ЖДА характеризуется нарушениями белкового обмена с возникновением дефицита белков в организме, что приводит к развитию отеков у беременной. При ЖДА развиваются дистрофические процессы в матке и плаценте, которые ведут к нарушению функции и формированию плацентарной недостаточности, у 10–15% отмечаются гипотония и слабость родовой деятельности. При этом развивающийся плод не получает в достаточном количестве полагающиеся ему питательные вещества и кислород, вследствие чего возникает задержка роста плода. Основными осложнениями беременности при ЖДА являются: угроза прерывания беременности (20–42%); гестоз (40%); артериальная гипотония (40%); преждевременная отслойка плаценты (25–35%); задержка роста плода (25%); преждевременные роды (11–42%). Роды часто осложняются кровотечениями. В послеродовом периоде могут возникать различные воспалительные осложнения (12%) [3, 5]. Даже при скрытом дефиците железа у 59% женщин отмечено неблагоприятное течение беременности в виде угрозы ее прерывания и гестоза [2, 5].
Одним из основных критериев ЖДА служит уровень гемоглобина, экспертами ВОЗ принята классификация анемии у беременных по концентрации гемоглобина (Hb) в крови:
• анемия легкой степени тяжести – концентрация Hb в крови от 90 до 110 г/л;
• умеренно выраженная анемия – концентрация Hb в крови от 89 до 70 г/л;
• тяжелая анемия – концентрация Hb в крови < 70 г/л.
Также к диагностическим критериям ЖДА относятся: цветовой показатель – < 0,85, микро- и анизоцитоз; средний диаметр эритроцитов – < 6,5 мкм; общая железосвязывающая способность сыворотки – > 64,4 мкмоль/л; сывороточное железо – < 12,6 мкмоль/л и уровень сывороточного ферритина (в норме 32–35 мкг/л), который служит индикатором дефицита железа в организме (≤ 12 мкг/л).
Для лечения ЖДА необходимы сбалансированная диета и назначение железосодержащих препаратов.
Cогласно Национальным рекомендациям «Клинические рекомендации (протоколы лечения) – железодефицитная анемия» (2015 г.), терапия железодефицитных состояний требует комплексного подхода, который включает коррекцию питания, применение лекарственных средств, строго соответствующих определенному патогенетическому варианту анемии, использование преимущественно препаратов орального применения, адекватно высокие суточные дозы одного препарата с хорошей переносимостью. Возможно назначение трансфузии эритроцитов по жизненным показаниям. Оценивают эффект лечения по клинико-лабораторным признакам, в т. ч. по ретикулоцитарному кризу [8].
В первую половину беременности рекомендуется суточный рацион, состоящий из 110 г белков, 80 г жиров и 350–400 г углеводов. Общая энергетическая ценность суточного рациона должна составлять 2600–2800 ккал. Во вторую половину беременности количество белков должно быть увеличено до 125 г, жиров – до 70–90 г, углеводов – до 400–420 г, калорийность питания составляет в этом случае 2900–3050 ккал. Таким образом, в физиологических условиях коррекция рациона может обеспечивать потребности организма в железе и предупреждать развитие железодефицитных состояний.
Однако, учитывая тот факт, что из пищи всасывается 2,5 мг железа в сутки, а из лекарственных препаратов – в 15–20 раз больше, необходима дотация железа лекарственными препаратами.
Рекомендуется назначение препаратов, содержащих Fe2+, FeSO4, из-за их лучшей абсорбции. Суточная доза для профилактики анемии и лечения легкой формы заболевания – 50–60 мг Fe2+, а для лечения выраженной анемии – 100–120 мг Fe2+. Железа сульфат назначают внутрь по 320 мг (соответствует 100 мг Fe2+) 2 р./сут строго за 1 ч до или через 2 ч после еды, т. к. на абсорбцию влияют различные ингредиенты пищи.
Наиболее предпочтительным является прием препаратов железа внутрь, а не в виде инъекций, т. к. в последнем случае чаще могут возникать различные побочные эффекты: запор, вздутие живота, понос, изжога, боли в желудке, тошнота, темный стул.
Причинами неэффективной терапии препаратами железа могут быть:
1) отсутствие ЖДА;
2) недостаточная доза лекарства;
3) недостаточная длительность лечения;
4) нарушение всасывания в кишечнике;
5) одновременный прием препаратов, уменьшающих всасывание железа;
6) имеющаяся незначительная кровопотеря (геморрой и пр.).
Из лекарственной формы всасывается не более 10–12% содержащегося в ней железа. При тяжелой степени дефицита железа показатель всасываемости железа может возрастать до 3-х раз. Повышению биодоступности железа способствуют присутствие аскорбиновой и янтарной кислот, фруктозы, цистеина и других акселераторов, а также использование в ряде препаратов специальных матриц, замедляющих высвобождение железа в кишечнике [3, 4].
Расчет суточного количества препарата (СКП) для пероральных препаратов железа выполняют по следующей формуле:
СКП = НСД/СЖП
где НСД – необходимая суточная доза двухвалентного или трехвалентного (не элементарного) железа (у взрослых – 200 мг/сут, у детей – 30–100 мг/сут);
СЖП – содержание двухвалентного или трехвалентного (не элементарного) железа в единице препарата (таблетке, капсуле, капле раствора, миллилитре сиропа или раствора) [5].
Расчет ориентировочной курсовой дозы препарата железа, назначаемого парентерально, может быть произведен по формуле с учетом массы тела больного и уровня гемоглобина, отражающего степень дефицита железа:
А=М(Hb1–Hb2) × 0,24+D,
где A – количество железа в мг;
M – масса тела в кг;
Hb1 – нормативная величина гемоглобина для массы тела < 35 кг – 130 г/л, > 35 кг – 150 г/л;
Hb2 – уровень гемоглобина у пациента в г/л;
D – расчетная величина депо железа для массы тела < 35 кг – 15 мг/кг, для массы тела > 35 кг – 500 мг.
Оптимальная суточная доза для препаратов железа при лечении ЖДА должна соответствовать необходимой суточной дозе и рассчитываться по приведенным формулам. Применение меньших доз препаратов не дает адекватного клинического эффекта. При латентном дефиците железа или для насыщения депо после окончания курса терапии применяются половинные относительно лечебных дозы препаратов [9].
Из железосодержащих препаратов особого внимания заслуживают многокомпонентные оральные препараты. Предпочтение данных препаратов обусловлено отсутствием или низкой частотой побочных эффектов, а главное, быстрым увеличением уровня гемоглобина и нормализацией показателей ферростатуса. Положительный эффект объясняется дополнительными компонентами в составе этих препаратов. Оптимальный препарат должен состоять из сульфата железа в достаточном количестве, аскорбиновой кислоты, превышающей в 2–5 раз количество железа в препарате, больших доз фолиевой кислоты и цианокобаламина. Эти компоненты принимают активное участие в процессах метаболизма железа в организме, обеспечивая лучшую абсорбцию этого микроэлемента из ЖКТ.
На сегодняшний день представлен большой выбор ферропрепаратов, различающихся по составу. Препаратом, наиболее удовлетворяющим всем основным требованиям, является Сорбифер.
Форма выпуска препарата в оболочке предотвращает образование желтой каймы на зубах при длительном приеме. Препарат содержит 320 мг сульфата железа (что соответствует100 мг двухвалентного железа) и 60 мг аскорбиновой кислоты (для улучшения всасывания и усвоения микроэлемента). Мы использовали схему приема препарата – 1 таблетка 2 р./сут. Основными достоинствами препарата являются наименьшая частота побочных эффектов, быстрое купирование объективных и субъективных клинических признаков ЖДА, хорошая переносимость [9, 10]. Эти качества наиболее важны при выборе метода лечения ЖДА у беременных. Дополнительные компоненты препарата обеспечивают лучшую абсорбцию железа и профилактику поливитаминной недостаточности у женщин во время беременности. Результаты исследований доказывают, что Сорбифер оказывает положительное влияние на общее состояние беременной.
Основные схемы лечения препаратом Сорбифер с приемом внутрь после еды: при анемии легкой формы – по 1 таблетке 2 р./сут в течение 3–4-х нед.; при среднетяжелом течении – по 1 таблетке 3 р./сут в течение 8–12 нед., при тяжелой форме – по 2 таблетки 3 р./сут в течение 16 нед. и более. Оценка первых результатов лечения (по уровню гемоглобина) проводится уже через 2 нед. от начала терапии [10].
Таким образом, в настоящее время комбинированный препарат Сорбифер можно считать препаратом выбора при лечении беременных с ЖДА.
Цель исследования: оценка эффективности применения препарата Сорбифер в коррекции ЖДА во время беременности.
Материал и методы
Для реализации поставленной цели были проведены клинико-лабораторное обследование и лечение 33 беременных во II триместре гестации (13–20 нед.) с ЖДА в сочетании с угрозой прерывания различного генеза.
Возраст беременных варьировал от 16 до 39 лет (средний возраст – 27,5±5,6 года).
Результаты анализа свидетельствуют, что характерными для обследованных пациенток явились следующие особенности: высокая частота инфекционных заболеваний, наличие сопутствующей экстрагенитальной патологии, особенно со стороны желудочно-кишечного тракта, хронические очаги инфекции, осложненное течение предыдущих беременностей. ЖДА при предыдущей беременности имела место у 14 (42%) женщин. В обследованной группе первобеременных было 5 (15,1%), первородящих – 9 (27,2%). Из 28 (84%) повторно беременных лишь у 11 (33%) женщин предыдущие беременности закончились срочными родами; у 5 (15,1%) пациенток в анамнезе были самопроизвольные выкидыши и у 3-х женщин (9%) – неразвивающаяся беременность.
Все пациентки предъявляли жалобы на общую слабость, утомляемость, нарушение сна и тянущие боли в низу живота.
Для подтверждения диагноза ЖДА проводилось исследование показателей периферической крови: уровня гемоглобина (Hb), эритроцитов, цветового показателя. Для оценки запасов железа использовано также определение уровня сывороточного железа (Fe) и ферритина (SF). О тяжести течения ЖДА судили по уровню гемоглобина. У 20 беременных имела место легкая степень анемии (снижение уровня гемоглобина от 90 до 110 г/л) и у 13 – средняя степень (снижение уровня гемоглобина от 70 до 89 г/л).
Все беременные, помимо терапии, направленной на пролонгирование беременности (спазмолитики, антиоксиданты, гормоны по показаниям), для лечения анемии получали препарат Сорбифер, который назначали внутрь после еды 3 р./сут в течение 3–4-х нед. при ЖДА легкой степени и в течение 8–10 нед. при ЖДА средней степени тяжести.
До назначения Сорбифера лечение другими железосодержащими препаратами не проводилось. У каждой беременной до и после приема препарата Сорбифер определяли гематологические и феррокинетические параметры.
Результаты и обсуждение
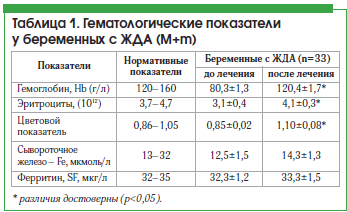
Результаты изучения показателей до и после лечения препаратом представлены в таблице 1.

Как видно из приведенных данных, у пациенток после лечения препаратом Сорбифер наблюдались достоверное (р<0,05) увеличение содержания гемоглобина, цветового показателя и уровня эритроцитов, а также увеличение уровня сывороточного железа, хотя разница показателей до и после лечения была недостоверной, что, возможно, связано с наличием легкой степени тяжести ЖДА у большинства пациенток (рис. 1). Нами не выявлено снижение уровня ферритина. Однако, согласно имеющимся данным, содержание сывороточного железа не всегда отражает показатели запасов железа, т. к. оно зависит от скорости высвобождения ферритина из тканей и плазмы [6].
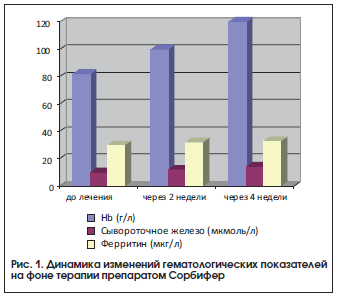
За время наблюдения состояние беременных значительно улучшилось: купировались признаки угрозы прерывания беременности, исчезли жалобы на слабость, утомляемость, нарушение сна. Необходимо также отметить, что за время лечения препаратом Сорбифер побочных эффектов, таких как аллергические реакции, желудочно-кишечные расстройства и др., не наблюдалось.
Таким образом, включение препарата Сорбифер в лечение беременных с ЖДА способствует нормализации показателей периферической крови, улучшению состояния пациенток, а также пролонгированию беременности, что является одним из факторов профилактики невынашивания беременности.
Анемия при беременности — это уменьшение уровня гемоглобина, возникшее в период гестации и связанное с ней патогенетически. Проявляется слабостью, быстрой утомляемостью, головокружениями, извращением вкуса и обонятельных предпочтений, кардиальными болями, мышечной слабостью, парестезиями, поражением слизистых, изменением кожи, ногтей, волос. Диагностируется с помощью общеклинического анализа крови и лабораторного исследования метаболизма железа. Для лечения применяют железосодержащие препараты, фолиевую кислоту, цианокобаламин, по показаниям проводят комплексную противогипоксическую терапию.
Общие сведения
Существование физиологических предпосылок для возникновения гестационной анемии (гидремии) делает это заболевание одним из наиболее распространенных видов патологии при беременности. Манифестные формы болезни с клинически выраженной симптоматикой в экономически развитых государствах встречаются у 16-21% пациенток, в развивающихся странах их распространенность достигает 80%. При этом скрытый (латентный) дефицит железа с учетом полноценности рациона к концу беременности наблюдается у 50-100% женщин. Преобладающая форма анемии гестационного периода — железодефицитная, диагностируемая в 75-95% случаев. Актуальность своевременного выявления патологии связана с высокой вероятностью осложненного течения беременности и возникновения гипоксических состояний на фоне физиологического повышения потребности в кислороде на 15-33%.

Анемия при беременности
Причины анемии при беременности
Недостаточное содержание гемоглобина и эритроцитов в крови беременной женщины обусловлено как факторами, непосредственно связанными с гестацией, так и предшествующими заболеваниями. По наблюдениям специалистов в сфере акушерства, у большинства пациенток гестационная гидремия имеет такие легко объяснимые физиологические причины, как:
- Повышенная потребность в железе. Начиная со II триместра беременности, для адекватного обслуживания фетоплацентарного комплекса требуется больше железа. Этот микроэлемент ускоренно потребляется растущим плодом, поступает в плаценту, используется для увеличения общего числа эритроцитов, циркулирующих в крови женщины. К началу III триместра суточная потребность беременной в железе составляет минимум 4-6 мг, а на 32-34 неделях его требуется не менее 10 мг/сут.
- Физиологическая гемодилюция. При беременности объем циркулирующей плазмы возрастает на 40-50%, а объем эритроцитарной массы лишь на 20-35%. Это обусловлено повышенной потребностью организма в железе и пластических веществах, при недостаточном поступлении которых темпы эритропоэза не соответствуют скорости нарастания ОЦК. Согласно рекомендациям ВОЗ, допустимый уровень гемоглобина у беременных снижен до 110,0 г/л, а гематокрит — до 33%.
Фактором, усугубляющим анемию в послеродовом периоде, становится физиологическая потеря до 150 мл крови в родах, в каждых 2,0-2,5 мл которой содержится до 1 мг железа. Специалисты также выделяют ряд патологических причин, вызывающих заболевание. Уменьшение объема эритроцитов (микроцитарный вариант анемии) с соответствующим падением уровня гемоглобина наблюдается при отравлении производственными ядами (например, свинцом), многих хронических болезнях (ревматизме, сахарном диабете, язвенной болезни, гастрите, хронических инфекционных процессах), сидеробластной анемии, талассемии. Данное состояние также возникает при железодефиците, обусловленном недостаточностью в рационе мяса и потреблением продуктов, содержащих негемовые формы микроэлемента (растительная пища, молоко и молокопродукты).
Нормоцитарная анемия со сниженным содержанием нормальных эритроцитов чаще отмечается при кровопотерях вследствие патологии плаценты, хронической почечной недостаточности, гипотиреозе, гипопитуитаризме, аутоиммунной гемолитической форме заболевания, угнетении эритропоэза в костном мозге. Макроцитарный тип анемии с увеличением объема эритроцитов характерен для дефицита фолиевой кислоты и витамина В12, острого миелодиспластического синдрома, печеночной патологии (гепатиты, цирроз), алкогольной зависимости, ретикулоцитоза. Дополнительными факторами риска являются низкий материальный уровень жизни беременной, частые роды, многоплодная беременность, долгое вскармливание грудью с коротким межродовым промежутком, осложненное течение настоящей беременности (выраженный ранний токсикоз с многократной рвотой, гестозы).
Патогенез
Механизм формирования анемии при беременности обычно связан с нарушением баланса между поступлением железа в организм, особенно в сочетании с дефицитом белка, фолиевой кислоты, витамина В12, и их высоким расходом в пластических целях. Дополнительным звеном патогенеза является угнетение эритропоэза за счет повышения концентрация эстрадиола и накопления метаболитов, токсически воздействующих на костный мозг. Ситуация усугубляется иммунологическими изменениями, связанными с постоянной стимуляцией организма матери антигенами плода, что повышает противотканевую сенсибилизацию. Результатами патофизиологических процессов становятся тканевая, гемическая и циркуляторная гипоксия с нарушениями метаболизма и дальнейшим накоплением вредных продуктов обмена.
Классификация
Оптимальными критериями систематизации форм анемии беременных являются концентрация гемоглобина в крови и элемент или вещество, дефицит которого привел к возникновению заболевания. Такой подход к классификации позволяет более точно прогнозировать вероятные осложнения и подбирать схему ведения беременности. Современные акушеры-гинекологи выделяют следующие формы гестационной анемии:
- По степени тяжести: согласно классификации ВОЗ с учетом уровня гемоглобина заболевание бывает легким (90-109 г/л), умеренно выраженным (70-89 г/л), тяжелым (менее 70 г/л).
- По типу дефицита: наиболее распространенной является железодефицитная анемия (в структуре заболеваемости занимает около 95%), реже встречаются фолиеводефицитная и В12-дефицитная формы болезни.
Симптомы анемии при беременности
Легкая степень обычно протекает латентно. При понижении концентрации железа менее 90 г/л становятся заметными признаки гемической гипоксии (собственно анемического синдрома) и железодефицита в тканях (сидеропенического синдрома). О возможном развитии кислородного голодания свидетельствуют общая слабость, головокружения, шум в ушах, дискомфорт и боль в прекардиальной области, жалобы на учащение сердцебиения, одышка при физнагрузках. Слизистые оболочки и кожа выглядят бледными. Женщина становится раздражительной, нервозной, невнимательной, у нее снижается память, ухудшается аппетит.
Тканевый железодефицит проявляется быстрой утомляемостью, извращенным вкусом (желанием есть штукатурку, мел, глину, песок, фарш, сырое мясо), утолщением и ломкостью ногтевых пластин, сухостью и выпадением волос, мышечной слабостью, недержанием мочи вследствие ослабления сфинктерного аппарата. У части пациенток поражаются эпителиальные оболочки: возникают трещины («заеды») в уголках рта, воспаляется слизистая ротовой полости, появляются жалобы на зуд, жжение в области вульвы. При умеренно выраженных и тяжелых анемиях нередко наблюдается незначительная желтизна ладоней и носогубного треугольника, связанная с нарушенным метаболизмом каротина при железодефиците, и «синева» склер, вызванная дистрофическими процессами.
Осложнения
Вероятность осложнений беременности напрямую зависит от выраженности нарушений и времени возникновения заболевания. Особенно неблагоприятна анемия, развившаяся до зачатия. В таких случаях возможны первичная плацентарная недостаточность, гипоплазия плодных оболочек, низкое расположение плаценты и ее предлежание, ранний выкидыш, неразвивающаяся беременность. При появлении анемического симптомокомплекса во II-III триместрах повышается риск гестозов, поздних выкидышей и преждевременных родов, преждевременной отслойки нормально расположенной плаценты.
При тяжелом течении заболевания возникает миокардиодистрофия, ухудшается сократительная способность сердечной мышцы. Как следствие, гемическая и тканевая гипоксии усугубляются циркуляторной, в результате страдают паренхиматозные органы беременной, наблюдается декомпенсация их функции. В родах у 10-15% рожениц выявляется слабость родовых сил, часто наблюдаются обильные кровотечения гипотонического типа. После родов у 10-12% родильниц и у 35-37% новорожденных развиваются различные гнойно-септические процессы. У 4 кормящих матерей из 10 отмечается гипогалактия.
Наличие у беременной анемии представляет непосредственную угрозу для ребенка. Перинатальная заболеваемость при такой патологии может возрастать до 100%, а смертность — до 14-15%. Вследствие фетоплацентарной недостаточности в 63% случаев отмечается гипоксия плода, в 40% — гипоксическая травма мозга, в 32% — задержка развития. Почти треть новорожденных рождаются в асфиксии. Дефицит витамина В12, фолиевой кислоты вызывает аномалии развития позвоночника и нервной системы (spina bifida и др.). У детей, матери которых при беременности страдали выраженной или тяжелой анемией, хуже устанавливается функция внешнего дыхания. В постнатальном периоде они чаще отстают в росте и массе тела, более склонны к возникновению инфекционных заболеваний.
Диагностика
Ключевыми задачами диагностического поиска при подозрении на анемию при беременности считаются оценка степени тяжести расстройства и своевременное выявление осложнений. Поскольку в большинстве случаев анемия является железодефицитной, для постановки диагноза наиболее информативны лабораторные методы определения уровня железа и гемоглобина:
- Общий анализ крови. Содержание гемоглобина составляет менее 110 г/л. Цветовой показатель снижен до 0,85. Количество эритроцитов ниже 3,5х1012 клеток/л. Отмечаются признаки микроцитоза (уменьшения диаметра эритроцитов менее 6,5 мкм). В морфологической картине эритроцитов возможны пойкилоцитоз, анизоцитоз.
- Исследование обмена железа. Уровень сывороточного железа составляет менее 12 мкмоль/л. Общая железосвязывающая способность сыворотки (ОЖСС) повышена до 85 мкмоль/л и более. Снижены концентрация ферритина (менее 15 мкг/л) и насыщение железом трансферрина (менее 16%). Увеличена латентная железосвязывающая способность крови (ЛЖСС).
Для исключения В12-дефицитного и фолиеводефицитного вариантов анемии, возникшей при беременности, определяют сывороточный уровень цианокобаламина и фолиевой кислоты. С учетом возможных осложнений со стороны плода рекомендована оценка его состояния в динамике с проведением фетометрии, кардиотокографии, фонокардиографии. Дифференциальная диагностика осуществляется между разными формами заболевания, гемоглобинопатиями, синдромом анемизации, вызванным осложнениями беременности, и экстрагенитальной патологией.
Лечение анемии при беременности
Основными задачами терапии у беременных со сниженным гемоглобином являются коррекция железодефицита, устранение проявлений гипоксии, стабилизация гемодинамики и метаболизма. При умеренно выраженном и тяжелом течении анемии особое внимание уделяется поддержке адекватного функционирования фетоплацентарного комплекса. Схема лечения включает лекарственные средства, позволяющие:
- Восстановить содержание гемоглобина. При железодефицитной анемии рекомендован пероральный прием оптимально высоких доз железа в удобной для усвоения двухвалентной форме. Предпочтительно использование препаратов-депо с медленным высвобождением элемента. Парентеральная коррекция анемии проводится при непереносимости двухвалентного железа, принимаемого внутрь, нарушении его всасывания слизистой ЖКТ, обострившейся язвенной болезни желудка или двенадцатиперстной кишки. Для более эффективного усвоения микроэлемента назначают аскорбиновую кислоту. Эксперты ВОЗ рекомендуют дополнять прием железосодержащих препаратов фолиевой кислотой, предупреждающей развитие фолиеводефицитной анемии. Дефицит цианокобаламина является основанием для парентерального введения витамина В12.
- Устранить последствия гипоксии. Чтобы обеспечить адекватное снабжение плода кислородом и питательными веществами, комплексно воздействуют на разные элементы системы маточно-плацентарного кровотока. Для усиления притока крови к плаценте применяют токолитики, расслабляющие маточную стенку. Микроциркуляцию можно улучшить при помощи ангиопротекторов и препаратов, оказывающих влияние на реологию крови. Назначение мембраностабилизаторов, антикосидантов, актовегина позволяет повысить устойчивость плода к гипоксии. Антигипоксическую терапию обычно применяют при II-III степенях анемии, осложнившейся фетоплацентарной недостаточностью. При необходимости используют препараты для коррекции метаболического ацидоза и улучшения сердечной деятельности беременной.
Противоанемическая терапия обычно является длительной, позволяет полностью нормализовать показатели красной крови только на 5-8 неделях лечения. Для повышения эффективности лекарственных средств обязательна коррекция диеты. Рекомендуется дополнить рацион продуктами, богатыми железом: говядиной, телятиной, нежирной ветчиной, свиной, говяжьей, куриной печенью, рыбой. Следует уменьшить количество пищи, ухудшающей всасывание железа: хлебных злаков, отрубей, сои, кукурузы, чая, кофе, молока, карбонатной, гидрокарбонатной, фосфатной минеральной воды. С осторожностью назначают альмагель, тетрациклины, соли магния и кальция, способные усугубить анемию.
Прогноз и профилактика
Анемия легкой степени, диагностируемая у большинства беременных женщин со сниженным уровнем гемоглобина, не представляет угрозы жизни матери и плода. Своевременная коррекция умеренной и тяжелой форм заболевания позволяет существенно улучшить показатели крови, предупредить развитие осложнений. Для предупреждения перинатальных и материнских осложнений рекомендованы сбалансированное питание, раннее назначение препаратов железа пациенткам с меноррагиями в анамнезе, коротким интервалом между родами, длительной лактацией после предыдущих родов, многоплодием. Женщинам с анемией следует уделять повышенное внимание в период родов для быстрого выявления и коррекции возможных нарушений родовой деятельности, послеродовых кровотечений.
