Высокое сродство гемоглобина к кислороду

Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
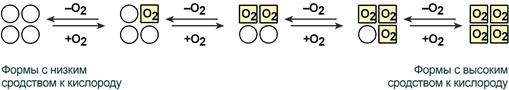
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Обеспечение кислородного режима организма при широком диапазоне колебаний р02 и рС02 в воде и различном функциональном состоянии рыб происходит в результате согласованной работы систем дыхания и кровообращения, а также изменения количества и функциональных свойств гемоглобина — дыхательного белка, способного обратимо связывать кислород в органах дыхания и отдавать его в активнодышащих тканях. Иными словами, снабжение организма кислородом на необходимом уровне при изменении его содержания в воде или кислородного запроса обеспечивается сложной физиолого-биохимической системой, в которой объединены органы дыхания, кровообращения и гемоглобин, определяющий кислородную емкость крови. Хотя кислород способен физически растворяться в плазме крови, но емкость этого “носителя” (0,5 мл/100 мл) значительно уступает кислородной емкости гемоглобина рыб (5—10 мл/100 мл крови). При этом следует иметь в виду, что кислородная емкость крови рыб, как правило, пропорциональна содержанию в ней гемоглобина и потому существенно колеблется от вида к виду (от 2,4—4,5 до 15,7—19,7 мл/100 мл крови). Однако кислородная емкость крови определяется не только количеством гемоглобина, но и рядом других факторов, влияющих на степень его сродства к гемоглобину, прежде всего содержанием двуокиси углерода и величиной рН крови.
Основным показателем сродства гемоглобина к кислороду служит концентрация кислорода в воде, а точнее, его напряжение (р02), при котором половина молекул гемоглобина насыщена кислородом (Я50 — напряжение полунасыщения) и находится в форме оксигемоглобина (НЬ02), а другая остается ненасыщенной (НЬ). Зависимость количества оксигемоглобина, а точнее, соотношение между гемоглобином и оксиге-моглобином при каждой данной концентрации кислорода в воде графически выражается кривыми кислородной диссоциации, которые еще называют кривыми кислородного насыщения. Как правило, эти кривые имеют сигмоидную форму, что отражает кооперативное взаимодействие субъединиц гемоглобина при связывании кислорода, и описываются уравнением
![]()
где у — процент гемоглобина, связанного с кислородом.
Чем ниже содержание кислорода в воде, при котором происходит полунасыщение (Psо), тем выше сродство гемоглобина к кислороду и наоборот. При высоком сродстве гемоглобина к кислороду кривые диссоциации оксигемоглобина сдвинуты влево, а при более низком — вправо. Гемоглобин с пониженным сродством к кислороду отдает его в тканях легче, чем гемоглобин с повышенным сродством к кислороду. Помимо р02, в воде многие другие факторы оказывают существенное влияние на связывание кислорода гемоглобином и кривые его диссоциации. Особое место среди них принадлежит С02 и другим кислотам, оказывающим влияние на рН крови.
Поступление двуокиси углерода в кровяное русло ведет к подкислению крови (снижению величины рН) и снижению сродства гемоглобина к кислороду.
Кривая кислородной диссоциации смещается вправо, т. е. при повышенной концентрации С02 имеет место повышенная отдача кислорода при любом заданном его напряжении в активнодышащих тканях.
Это явление называется прямым эффектом Бора. Оно имеет ярко выраженное адаптивное значение: при поступлении С02 из тканей в капилляры гемоглобин отдает больше кислорода, чем это было бы без двуокиси углерода. Эффект Бора облегчает доставку тканям дополнительного кислорода, потребность в котором увеличивается при различных функциональных нагрузках на организм. Вместе с тем в жабрах рыб по мере отдачи С02 связывание кислорода гемоглобином увеличивается. Показателем выраженности эффекта Бора служит изменение величины Pso на единицу рН.
Наряду с прямым эффектом Бора существует обратный эффект, или эффект Холдена, т. е. повышение сродства гемоглобина к С02 при его дезоксигенации в тканях и облегчение отдачи С02 крови при ее оксигенации в жабрах. Оба этих эффекта связаны с кислотными свойствами гемоглобина.
Мы уже отмечали, что оксигемоглобин — более сильная кислота, чем дезоксигемоглобин, поскольку при оксигенации кислые группы белка каждой из субъединиц гемоглобина снижают рК. При соединении гемоглобина с кислородом его отрицательный заряд увеличивается, вытесняется соответствующее количество ионов НСОз и облегчается отдача С02.
Повышенное содержание С02 в крови снижает не только сродство гемоглобина к кислороду, но и общую кислородную емкость крови — эффект Рута. При подкислении крови избытком С02 или других кислот снижается величина максимального насыщения крови кислородом при любом р02. Эффект Рута, вызванный избытком С02, наступает быстрее, чем вызванный эквивалентным количеством молочной кислоты.
Таким образом, избыток С02, ведущий к снижению рН крови, оказывает существенное влияние на функциональные свойства гемоглобина и прежде всего на степень его сродства к кислороду и к самой двуокиси углерода. Интересно, что гиперкапния оказывает на сродство гемоглобина к кислороду и кислородную емкость крови рыб более существенное воздействие, чем у млекопитающих. Между тем системы дыхания и кровообращения у наземных позвоночных и, в частности у млекопитающих, более чувствительны к избытку С02, чем у рыб. Из этого следует, что в адаптивных перестройках физиолого-биохимической системы обеспечения кислородного режима организма рыб важнейшая роль принадлежит биохимической компоненте этой системы, т. е. изменению функциональных свойств гемоглобина. Видимо, поэтому влияние двуокиси углерода и рН крови на кривые диссоциации гемоглобина и кислородную емкость крови у многих видов рыб выражены сильнее, чем у млекопитающих. Правда, выраженность эффектов Бора и Рута у разных по экологии видов рыб существенно различается. У рыб, обитающих в малопроточных, обедненных кислородом водах, гемоглобин которых обладает высоким сродством к кислороду, двуокись углерода оказывает менее выраженное воздействие на кривые диссоциации, изменения которых лежат в физиологических пределах.
Так, например, у карпа, сома, ильной рыбы при рС02, равном 10 мм рт.ст., напряжение полунасыщения гемоглобина составляет около 10 мм рт.ст., в то время как у высокоподвижных и оксифильных рыб (3 вида форели, чукучан) аналогичное повышение напряжения двуокиси углерода в воде приводит к увеличению Р50 гемоглобина до 35 мм рт.ст. Даже при значительно меньшем увеличении напряжения С02 (от 2 до 10 мм рт.ст.) у рыб с высоким Рso кривые диссоциации оксигемоглобина могут быть резко сдвинуты вправо. Углекислота, облегчая отдачу кислорода тканям, значительно затрудняет насыщение гемоглобина кислородом в жабрах. В результате у рыб может развиться гипоксия даже при нормальном содержании кислорода в воде. У высокоактивных рыб, таких, как форель, при мышечной работе в крови появляется больше молочной кислоты, чем у малоактивных (сом, карп), поэтому эффект Бора у первых выражен сильнее, чем у вторых. Эти молекулярные особенности гемоглобина благоприятны для функционирования в экстремальных условиях, когда активнодышащие ткани нуждаются в повышенном притоке кислорода и возникает необходимость высвобождать его. Вместе с тем повышенная чувствительность гемоглобина к ионам Н+ у активных рыб имеет и свою вторую, но уже негативную сторону, поскольку при длительном интенсивном плавании, т. е. при напряженной работе, в кровяное русло поступает огромное количество молочной кислоты. В этих случаях, при снижении рН крови, эффект Бора будет угнетать процесс связывания гемоглобином кислорода в жабрах, что может привести и, подчас, приводит даже к гибели рыб от асфиксии. Поэтому чрезвычайный интерес представляют пока еще малочисленные данные о наличии у некоторых видов рыб двух типов гемоглобина: чувствительного к ионам Н+ с ярко выраженным эффектом Бора и нечувствительного к ионам Н+, не проявляющего эффект Бора. Гемоглобин первого типа в присутствии высоких концентраций С02 теряет способность связывать кислород, а второго сохраняет ее. У японского угря один из двух выявленных типов гемоглобина — Ei обладает повышенным сродством к кислороду {Р$о — 2,1 мм рт.ст.) и не обнаруживает эффекта Бора, а второй тип гемоглобина — ?2 имеет пониженное сродство к кислороду (Р%о — 14 мм рт.ст.) и выраженный эффект Бора. Количественно преобладает второй тип гемоглобина (Ei : Е2 = 3 : 7).
Мы разделяем предположение, что гемоглобин без эффекта Бора служит для системы транспорта 02 важным аварийным резервом, который может быть использован в любом случае, когда основные формы гемоглобина будут испытывать сильную отрицательную модуляцию в результате метаболического ацидоза.
Снижение общей кислородной емкости крови под влиянием С02 и подкисление крови иного происхождения (эффект Рута) проявляется у многих рыб, но не у всех. Выраженный эффект Рута отмечен, как правило, у высокоактивных рыб, таких, как форель, скумбрия, морской петух. Так, например, увеличение рС02 до 10 мм рт.ст. снижает кислородную емкость крови у морского петуха на 40%. При рС02, равном 30 мм рт.ст., насыщение крови кислородом у морского петуха снижается почти на 60%, у опсануса на 45%, у скумбрии на 30%. У некоторых малоподвижных рыб (скат, рыба-прилипала) эффект Рута отсутствует. У двоякодышащей рыбы Neoceratodus эффект Бора есть, а эффект Рута отсутствует, у акулы Squalus отсутствуют оба эффекта. Все эти данные свидетельствуют о том, что выраженность влияния избытка двуокиси углерода, так же как и концентрации водородных ионов, на сродство гемоглобина к кислороду и кислородную емкость крови неодинаковы у разных видов рыб и во многом определяются особенностями их экологии.
Физиолого-биохимические изменения при низких рН. Концентрация водородных ионов в воде является важнейшим экологическим эффектом, изменение которого оказывает существенное влияние на функциональное состояние и биохимический статус рыб. Повышение концентрации Н+ (снижение величины рН) в пресноводных водоемах вследствие усиленного поступления С02 органического происхождения (в ночные часы), сброса кислых стоков в водоем или выпадения “кислых дождей” ведет к развитию разных по направленности, длительности, выраженности и обратимости полифункциональных физиолого-биохимических изменений в организме рыб.
Еще в 30-х годах было установлено, что снижение величины рН и “закисление”воды вызывают у многих видов пресноводных рыб (девя-тииглая колюшка, карась, гольян, форель, карп и 5 видов окуней) угнетение дыхания, снижение интенсивности потребления кислорода и повышение его пороговой концентрации. Так, например, при рН, равном 7,0, гипоксия у голубого окуня развивается при концентрации кислорода 2,25 мл/л, а снижение величины рН всего лишь на единицу (до 6,0) – уже при 5 мл/л 02.
По данным Т. В. Новиковой, интенсивность потребления кислорода у карпа снижается с 0,24 до 0,16, а у окуня с 0,12 до 0,10 мг 02 на 1 г живой массы за 1 ч. Из этого следует, что окунь значительно более устойчив к изменениям величины рН, чем карп.
Как мы уже отмечали в предыдущих разделах, снижение величины рН, вызванное избыточным содержанием двуокиси углерода или лактата в крови, а также под влиянием любых других причин приводит к снижению сродства гемоглобина к кислороду. При этом кривые диссоциации смещаются вправо и изменяется их сигмоидная форма. Снижение сродства гемоглобина к кислороду и кислородной емкости крови (эффекты Бора и Рута) неизбежно ведет к развитию эндогенной гипоксии даже при нормальном содержании кислорода в воде. Свидетельством тому могут служить экспериментальные данные об увеличении содержания гемоглобина, количества эритроцитов и молочной кислоты в крови рыб при кислотном стрессе.
Так, например, под влиянием низких рН (3,0-4,0) у форели происходит увеличение концентрации гемоглобина на 29%, количества эритроцитов на 23% и гематокрита на 17%. Однонаправленные изменения концентрации гемоглобина и числа эритроцитов, способствующие увеличению кислородной емкости крови, вполне обоснованно рассматриваются в качестве компенсаторной реакции на возникающую у рыб под влиянием низких рН гипоксию.
При снижении рН воды до 4,2 у ручьевой форели отмечено повышение напряжения двуокиси углерода в артериальной крови, величины гематокрита и увеличение вентиляции жабр. Существует, однако, мнение, что в отсутствие С02 гипервентиляция жабр у лососевых рыб выражена слабо или не проявляется вообще.
X. Эллис был, по-видимому, первым, кто отметил повреждающее действие низких рН на жабры, а также усиленное образование, накопление и коагуляцию жаберной слизи.
Образующаяся при этом на жаберном эпителии коагуляционная пленка служит дополнительным препятствием для нормального газообмена вследствие увеличения диффузионного барьера. В дальнейшем гистопатологические изменения жаберной ткани рыб (гиперемия, деструкция и отслоение клеток жаберного эпителия от эндотелия капилляров) и усиленную секрецию слизи при остром и подостром кислотном отравлении отмечал каждый, кто изучал этот вопрос.
Нам известна всего лишь одна работа, в которой авторам лочему-то не удалось обнаружить патологических изменений жаберной ткани и образование слизи у ручьевой форели даже к моменту гибели после 7,5 часового воздействия остролетальной величины рН, равной 3,4. Это тем боле странно, что у такого высокоустойчивого ко многим стрессорным воздействиям вида рыб, каким является серебряный карась, уже в течение первого часа при рН 4,0 отмечено выраженное разрушение жаберного эпителия. В проверочной тщательно выполненной работе на том же виде рыб — на ручьевой форели было показано, что уже при рН 5,2 происходит гипертрофия слизистых клеток жаберного эпителия, а на жабрах накапливается слизь. В дальнейшем с увеличением кислотности воды до 3,5 отмечено разрушение жаберного эпителия и его отторжение от опорных клеток. Накопление слизи на жабрах в период, когда дыхание особенно затруднено, отмечено и у других видов лососевых рыб.
Объективный анализ накопленных экспериментальных данных позволяет считать твердо установленным, что первичной точкой приложения действия низких величин рН или “органом-мишенью” являются жабры и их ведущая функция — газообмен, т. е. обеспечение организма кислородом и освобождение от избытка двуокиси углерода.
Однако обеспечение дыхательного гомеостаза является важнейшей, но не единственной функцией жабр.
Наряду с почками жабры играют активную роль в поддержании водно-солевого гомеостаза, обеспечивая ионное и осмотическое постоянство внутренней среды. Обитая в резко различающихся по концентрации неорганических ионов морских и пресных водах, рыбы вынуждены с помощью различных морфофизиологических и физиолого-биохимических механизмов постоянно решать проблему стабилизации химического состава внутренней среды, т. е. изолировать внутриклеточные и внеклеточные жидкости от прямого влияния повышенной, или пониженной, солености окружающей среды. Основой решения этой проблемы служит непроницаемость для воды и ионов поверхность тела рыб. Исключение составляют именно жабры, непроницаемость которых сделала бы невозможной обеспечение рыб кислородом. Между тем через жабры идет постоянная “утечка” ионов из организма пресноводных рыб. По современным данным экстраренальные потери достигают 75-90% солей.
Для компенсации неизбежных потерь ионов рыбы располагают механизмом активного переноса ионов против концентрационного градиента из окружающей среды в организм или из организма в окружающую среду. Эти ионные насосы (главным образом натриевый) работают за счет энергии гидролиза АТФ. В энергетическом отношении это чрезвычайно дорогое физиолого-биохимическое приспособление (до 30% всех энергозатрат), однако оно обеспечило саму возможность существования рыб в условиях резких ионных градиентов между организмом и средой. Локализованы ионные насосы в уязвимых точках поверхности тела, т. е. в жабрах, где происходит интенсивный трансэпителиальный ионный обмен между организмом и средой. Особо следует подчеркнуть, что транспорт растворенных веществ через эпителий всегда сопряжен с переносом воды, в связи с чем проблема поддержания водно-солевого равновесия решается совместной деятельностью двух основных осморегуляторных органов — жабр и почек.
Также рекомендуем прочитать:
- Двуокись углерода и концентрация водородных ионов – буферная емкость крови
- Влияние избытка двуокиси углерода на систему обеспечения кислородного режима организма рыб
- Неясен и механизм ингибирующего влияния высоких концентраций водородных ионов на активный транспорт натрия
- Степень сродства гемоглобина к кислороду у рыб
- В условиях научно-технического прогресса города оказывают все большее влияние
- Влияние дождевых червей на структуру и химический состав почв
- Влияние животного населения на растительные сообщества глубоко осветили А. Г. Воронов и М. С
- Влияние изменений температуры на вегетативные процессы у морских рыб
- Влияние измененного гидробиологического режима водоема на жизнедеятельность рыб
- Влияние измененного гидрохимического режима водоема на жизнедеятельность рыб
- Влияние светового голодания на жителей крайнего Севера и Заполярья
- Влияние средовых условий на проявление комбинационной способности образцов томата
- Влияние средовых условий на эффективность отбора и экологическую стабильность генотипов томата
- Влияние среды на эффективность отбора в ранних поколениях
- Влияние токсических водорослей на рыб


