Взаимодействие no с гемоглобином

Молекула гемоглобина состоит из двух a- и двух b-полипептидных цепей, каждая из которых связана с гемической группой, содержащей порфириновое кольцо и атом Fe2+, способный обратимо связывать 1 молекулу О2. Глобиновые субъединицы дезоксигемоглобина тесно удерживаются электростатическими связями в плотной Т-конформации со сравнительно низким сродством к О2 . Присоединение О2 разрывает эти электростатические связи, ведя к релаксированной R-конформации, в которой остальные связывающиеся участки молекулы гемоглобина имеют сродство к О2 в 500 раз выше, чем в Т-конформации. Эти изменения ведут к кооперативности между связывающими участками так, что присоединение одной молекулы О2 с дезоксигемоглобином повышает сродство к нему остальных связывающих участков на этой же молекуле. В организме СГК в значительной степени определяет диффузию кислорода из альвеолярного воздуха в кровь, а затем на уровне капилляров в ткань. Свойство гемоглобина обратимо связывать кислород, является частным случаем общей закономерности взаимодействия протеинов с лигандами. Представляет интерес изучение взаимодействия гемоглобина с NO , так как он имеет гораздо более высокое сродство к гемической группе дезоксигемоглобина, чем О2 и CO, что позволяет предполагать его конкурирование с кислородом за соответствующие участки на молекулах частично оксигенированного гемоглобина.
Взаимодействие NO с гемоглобином в эритроцитах важно для регуляции обеих этих молекул in vivo . Существующие свойства эритроцитов не ограничивают взаимодействие гемоглобина с NO в физиологических условиях, не только не разрушая его биоактивность, но и сохраняя ее. На модели кишечника, в которой создавалась окклюзия верхней брыжеечной артерии и оценивалось образование HbFe2+NO и диэтилдиокарбаната с железом, показано, что NO , высвобождаемый из эндотелиальных клеток диффундирует, прежде всего, не в ткань, а в кровь. При внутриартериальном введении крысам динитрозильных комплексов железа в крови регистрировали сигнал ЭПР парамагнитного мононитрозильного комплекса, локализованного в основном (до 90%) в форменных элементах крови. В плазме в отличие от цельной крови NO превращается в нитрат довольно не эффективно, что указывает на активное участие форменных элементов крови в его метаболизме. Реакция NO с гемической группой гемоглобина может быть частично ограничена гидрофобным компонентом клеточной мембраны, лимитируя процесс его диффузии в эритроцит. NO переносится через клеточную мембрану посредством специального переносчика протеина AE1, или анион-обменник. Проницаемость эритроцитарной мембраны для NO сравнительно невысока, что может иметь значение для его биодоступности, реакции NO с гемоглобином. Предполагается существование цитоскелетного барьера для диффузии NO , реализуемого через особые межбелковые бреши (поры) в эритроцитарной мембране, состояние некоторых регулируемо, и соответственно изменяет вход NO. Скорость реакции гемоглобина с NO, находящегося в эритроцитах, в 800 раз меньше, нежели с эквивалентным количеством свободного гемоглобина. В тоже время показано, что клеточная мембрана эритроцитов не является существенным барьером для NO и его производных и не лимитирует его взаимодействие с гемоглобином. Мембрана эритроцитов рассматривается как некий специализированный насос для NO. Она имеет два компартмента для гемоглобина и активно регулирует транспорт NO из клетки: один находится внутри, а другой – на мембране. Регулируемый кислородом клеточный механизм сопряжения синтеза и экспорта биоактивности NO, образуемого гемоглобином, действует через мембранный механизм (комплекс АЕ1-SNO). Критическими факторами, определяющими скорость захвата NO эритроцитами, является ориентация мембранных молекул и внутриклеточное перераспределение гемоглобина.
В артериальной крови NO в реакции с оксигемоглобином образует нитрат и метгемоглобин, а в венозной – нитрозилгемоглобин (HbFe2+ NO), способный при высоких рО2 распадаться с высвобождением молекулы NO, которая окисляется в присутствии кислорода до NO3- [80]. Гемоглобин взаимодействует с NO через высокоаффинные Fe2+-связывающие участки на геме, его сродство к NO в 8000 раз выше, чем к О2. HbFe2+NO имеет шестикоординатную форму гемических групп. Спектр ЭПР HbFe2+ NO в растворе является суперпозицией спектров T- и R -конформеров гемоглобина с преимущественным образованием Т-формы, которые обусловлены обратимыми переходами от сильного (R) до слабого (Т) взаимодействия Fe2+-гем с проксимальным гистидином. Нитрозилгемоглобин характеризуется выраженным эффектом Бора, что может иметь особенно важное значение при ацидозе. Указывается на возможность реагирования HbFe2+ NO с O2 – с образованием аддукта гема с ONOO- и последующим образовании NO3-.
Существуют и другие физиологические механизмы связывания циркулирующего в крови NO. Недавно было установлен участок в глобиновой цепи гемоглобина, в котором NO связывается в форме S-нитрозотиола, а именно S-нитрозогемоглобина (SNO-Hb). Масс-спектрометрические и кристаллографические данные однозначно идентифицировали b93-цистеин как место связывания NO с гемоглобином. При очень больших концентрациях нитрозотиолов in vitro образуются и другие формы SNO – Hb , у которых нитрозилируется аминокислота цистеин в положении 12 и 104 b- и a-белковых цепей, соответственно. NO, образуемый in vitro при добавлении индуцибельной изоформы NO-синтазы к эритроцитам, может превращать содержащийся в них гемоглобин в SNO-Hb. Кислородсвязывающие свойства SNO-Hb сильно зависят от pH (величина эффекта Бора для него близка к обычному гемоглобину). Протонирование соответствующих аминокислот (b146-гистидина и b93-цистеина) взаимосвязано, что может способствовать высвобождению NO. S-нитрозилирование гемоглобина облегчает отсоединение NO с гема и поступление его к гипоксическим тканям. SNO-Hb выступает в роли акцептора или донора е- , внося тем самым вклад в редокс-равновесие гема, однако значение этих функций минимально в условиях покоя.
Перенос NO от S-нитрозотиола на гемоглобин регулируется аллостерически и функционально связан с присоединением О2. По мере связывания гемоглобина с О2 в лёгких его сродство для S-нитрозотиола растёт, а при отдаче снижается, благодаря чему NO высвобождается в ткани. Существует О2-зависимое равновесие между SNO-Hb и HbFe2+NO (при отсутствии низкомолекулярных тиолов вроде цистеина, мишенью NO является гем с Fe 2+ , а в его присутствии следует перенос NO-группы на цистеиновый остаток b-глобина). Положение редокс-равновесия между SNO-Hb и HbFe2+ NO связано с аллостерическим состоянием гемоглобина. После дезоксигенации большая доля SNO-HbO2 превращается в HbFe2+ NO. Дезоксигенация облегчает как реакцию транснитрозирования, в которой получаются вазорелаксирующие нитрозотиолы, так и восстановительную реакцию запасания NO, образующую нитрозилгемоглобин.
HbFe2+ NO + 4О2 SNO-Hb(О2)4 + e-
Артериовенозное распределение HbFe2+NO обратно пропорционально SNO-Hb, т.е. большие концентрации нитрозильного гемоглобина обнаруживаются в деоксигенированной крови, и наоборот. Существует цикл связывания О2 и NO в легких и их высвобождения на периферии. SH-группа S-нитрозотиола существенно защищает NO от гашения присоединением к гему. Равновесие между HbFe2+NO и SNO-Hb связано с конформацией белка: образование SNO-Hb облегчается в R-структуре, а HbFe2+NO преимущественно образуется в Т. Высвобождению NO из тиолов способствуют дезоксигенация и окисление гема (Т-структура, высокоспиновая); что согласуется с термодинамическими особенностями его связывания. Первичным аддуктом гемоглобина и NO , образуемого при дыхании NO, у нормальных индивидуумов является HbFe2+NO и в небольшом количестве SNO-Hb. SNO-Hb также находится в равновесии с низкомолекулярными нитрозотиолами. Гидроксимочевина реагирует с различными формами гемоглобина, образуя до 6% HbFe2+NO и не образовывая SNO-Hb.
Глутатион может влиять на равновесие SNO-Hb и HbFe2+ NO , что может влиять на процессы оксигенации и деоксигенации крови в капиллярах малого и большого кругов кровообращения. NO, высвобождаемый из SNO – Hb в присутствии глутатиона, не вызывает заметных сосудистых эффектов в изолированном легком в связи с быстрым окислением NO и образования метгемоглобина. Главным продуктом взаимодействия GSH с SNO-Hb in vivo, вероятно, является HbFe2+NO, за счет чего происходит модификация СГК, сдвиг кривой диссоциации оксигемоглобина вправо.
SNO-Hb(О2) +GSH + e- « HbFe2+NO + GS- + О2
Анализируя взаимодействие in vivo NO с Hb предполагается следующие соотношения между реакциями, ведущими к образованию NO-производных: метгемоглобин и NO3 + >>> HbFe2 + NO > SNO-Hb, хотя другие авторы указывают на более высокое содержание HbFe2+ NO и SNO-Hb, преобладающее над уровнем метгемоглобина. Связывание NO с оксигемоглобином является кооперативным, его окисление в метгемоглобин при физиологических условиях ограничено и преобладают реакции, ведущие к усиленному образованию HbFe2+NO. Исследование реакции с NO и гемоглобином, ведущих к образованию метгемоглобина, далеко не всегда доминируют в условиях in vivo. Взаимодействие NO с HbO2 не уничтожает его активность, а более того, обеспечивает его сохранение («гемоглобин рационально вводит новую химию, когда его насыщение кислородом высоко, лимитируя окисление NO и сохраняя его биоактивность»).
Нитрозогемоглобин
(Hb-SNO)
– продукт связывания оксида азота с
SH-группами
свободного гемоглобина Hb-SH
+ NO
= Hb-SNO
Hb-SNO
оказывает сосудорасширяющее действие
и усиливает кровоток в сосудах.
Переход
оксигемоглобина в состояние
дезоксигемоглобина (то есть отдача
кислорода) приводит к освобождению
оксида азота
Hb-SNO
= Hb-SH
+ NO
При
связывании оксида азота с оксигемоглобином
(HbO2)
образуется метгемоглобин HbO2
+ NO
= metHb
+ NO3
Нитрозильный
гемоглобин (Hb-NO)
– продукт связывания оксида азота с
железом гема. Нитрозильные комплексы
гемоглобина присутствуют как в
артериальной, так и в венозной крови.
При физиологическом насыщении гемоглобина
кислородом до 10-40% оксид азота связывается
с гемом гемоглобина в виде Hb-NO.
Hb
+ NO
= Hb-NO.
Оставшаяся часть оксида азота связывается
с тиоловыми группами гемоглобина с
образованием Hb-SNO.
При
отдаче кислорода часть оксида азота
связывается с SH
группой цистеина переходит от связи с
тиоловыми группами на связь с гемом,
либо высвобождается в виде оксида азота.
Hb-SNO
= Hb-SH + NO
Таким
образом Hb-SNO
и Hb-NO
и нитрозильные комплексы негемового
железа образуют большой пул депонированного
оксида азота.
Реакция
с гемопротеинами – гемосодержащей
гуаниллатциклазой, гемоглобином: Hb
+ NO2
+ 2H
= metHb
+ NO
+ H2O
8. Неферментативный путь синтеза у животных
Неферментативный
путь синтеза оксида азота происходит
из нитритов и нитратов. На направленность
реакции влияет рН среды.
При
рН=7 оксид азота синтезируется из нитритов
путем их восстановления с помощью
гемсодержащих белков – гемоглобином,
миоглобином, цитохром с оксидазой,
цитохром Р-450. Наиболее эффективным
восстановителем нитритов является
гемоглобин.
Hb
+ NO2 + 2H = metHb + NO + H2O
При
рН<6 синтезу оксида азота из нитритов
способствует высокая концентрация
протонов водорода.
NO2
+ H = HNO2
NO2
+ HNO2 = N2O3 + OH
N2O3
= NO2
+ NO
9. Ферментативный путь синтеза у животных. Соа
Ферментативный
путь синтеза оксида азота из аминокислоты
аргинина белками NO-синтазами
или СОА (синтазы оксида азота).
Помимо
оксида азота синтезируется аминокислота
цитрулин.
2
l-агринин
+ 3NADPH
+ 4O2
+ 3H
= 2l-цитрулин
+ 2NO
+ 3NADP
+ 4H2O
Существует
две изоформы СОА: конститутивная
(постоянно синтезируемая) и индуцибельная.
Конститутивная
синтаза делиться на нейрональную (nCOA),
эндотелиальную (eCOA)
и митохондриальную (mCOA)
NO-синтазу.
nCOA
экспрессируется в нейронах, микроглии,
астроцитах и мышечных клетках скелетной
мускулатуры.
eCOA
экспрессируется в эндотелиальных и
гладкомышечных клетках.
mCOA
экспрессируется в митохондриях.
Для
активации конститутивных форм СОА
необходимо присутствие ионов кальция
и кальмодулина.
Индуцибельная
СОА (iCOA)
может присутствовать в нейтрофилах и
макрофагах, то есть в клетках присутствующих
в очаге воспаления и синтезируется в
ответ на внешнее воздействие. В отличие
от конститутивных форм не требуется
присутствие ионов кальция для активации.
Все
изомеры СОА осуществляют присоединение
молекулярного кислорода к атому азота
из терминальной гуанидиновой группы
аргинина.
Все
изоформы СОА имеют сходную структуру
и осуществляют свое действие при наличии
множества кофакторов, в том числе
флавинов, тетрагидробиоптерина, NADPH.
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
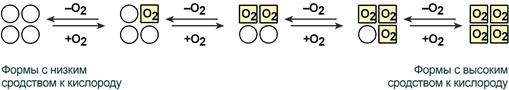
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Гемоглобин (НЬ)– сложный олигомерный белок, состоящий из 4 протомеров двух типов (2α и 2β), включающих 574 аминокислотных остатка. Содержится в эритроцитах, на его долю приходится до 90% массы белков клетки. Гемоглобин обеспечивает перенос кислорода из легких в ткани и удаление диоксида углерода из тканей.
В мышцах внутриклеточный транспорт и кратковременное депонирование кислорода осуществляет другой белок – миоглобин (Mb). Он не является олигомером, так как состоит только из одной полипептидной цепи, конформация которой очень похожа на пространственную структуру β-цепи гемоглобина (рис. 1.20). Большую часть молекулы
Рис. 1.20. Структура миоглобина иβ-цепи гемоглобина
А– миоглобин; Б– β-цепь гемоглобина
Mb и протомеров Hb составляют 8 α-спиральных участков, образующих глобулу с гидрофобным углублением, в котором находится центр связывания с кислородом (активный центр).При этом полипептидные цепи миоглобина и протомеров гемоглобина идентичны всего на 20%.
Оба белка являются холопротеинами, простетическая группа – гем, который находится в активном центре и участвует во взаимодействии с кислородом (рис. 1.21). Гем(ферропротопорфирин) представляет собой органическое соединение с плоской молекулой, включающей 4 пиррольных цикла и ион железа Fe2+. Он является окрашенным соединением и придает красный цвет гемоглобину, эритроцитам (красные кровяные тельца) и крови.
Гем присоединяется к неполярным радикалам активного центра своими пиррольными циклами, а также к радикалу гистидина с помощью атома Fe. Пиррольные кольца гема расположены в одной плоскости, а ион Fe2+ в неоксигенированом состоянии Hb выступает над плоскостью на 0,6 А. При присоединении кислорода ион железа погружается в плоскость колец гема (рис. 1.22). В результате сдвигается и участок полипептидной цепи, нарушаются слабые связи в молекуле Hb и изменяется конформация всей глобулы. Таким образом, присоединение кислорода вызывает изменение пространственной структуры молекулы миоглобина или протомеров гемоглобина.
Рис. 1.21. Строение гемоглобина и гема
А– гемоглобин– сложный белок, олигомер, состоит из 2 α- и 2 β-субъединиц глобина, каждая имеет центр связывания, где располагается небелковая часть молекулы – гем. Он участвует в присоединении молекулы кислорода. Между протомерами образуется аллостерический центр для присоединения регуляторного лиганда гемоглобина 2,3-бисфосфоглицерата;
Б– гем– простетическая группа гемоглобина, миоглобина и других гемопротеинов. Связывается с глобином гидрофобными связями между пиррольными циклами и гидрофобными радикалами аминокислот. В центре молеку-
2+
лы расположен ион железа (Fe ), который образует 6 координационных связей: 4 – с атомами азота пиррольных колец гема, 1 – с азотом радикала гистидина цепей глобина, 1 – с молекулой кислорода. В присоединении О2к гему участвует еще один радикал гистидина цепи глобина
Рис. 1.22. Взаимодействие кислорода с гемом в миоглобине и гемоглобине
Молекула миоглобина может присоединять только 1 молекулу кислорода в свой активный центр:
Гемоглобин является олигомерным белком и имеет ряд особенностей функционирования, характерных для всех олигомерных белков. Молекула гемоглобина состоит из 4 протомеров и имеет 4 центра связывания О2 (активные центры). Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до 4 молекул кислорода. Взаимодействие с кислородом 1-го протомера вызывает изменение его конформации, а также кооперативные конформационные изменения остальных протомеров (рис. 1.23, А). Сродство к кислороду возрастает, и присоединение О2 к активному центру 2-го протомера происходит легче, вызывая дальнейшую конформационную перестройку всей молекулы. В результате еще сильнее изменяется структура оставшихся протомеров и их активных центров, взаимодействие с О2 еще больше облегчается. В итоге 4-я молекула кислорода присоединяется к Hb примерно в 300 раз легче, чем 1-я (рис. 1.23, Б). Так происходит в легких при высоком парциальном давлении кислорода. В тканях, где содержание кислорода
ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих.
Таким образом, взаимодействие олигомерного белка гемоглобина с лигандом (О2) в одном центре связывания приводит к изменению конформации всей молекулы и других, пространственно удаленных центров, расположенных на других субъединицах (принцип «домино»). Подобные взаимосвязанные изменения структуры белка называют кооперативными конформационными изменениями.Они характерны для всех олигомерных белков и используются для регуляции их активности.
Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в тканях. Эта зависимость имеет разный характер, что связано с их особенностями структуры и функционирования (рис. 1.24).
Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет освобождение остальных молекул О2. Этот процесс зависит от изменения парциального давления кислорода в тканях.
График насыщения миоглобина кислородом имеет характер простой гиперболы, т.е. насыщение Mb кислородом происходит быстро и отражает его функцию – обратимое связывание с
Рис. 1.23. Кооперативные изменения конформации молекулы гемоглобина при взаимодействии с кислородом
А– при взаимодействии молекулы дезоксигемоглобина НЬ с О2 происходят кооперативные конформационные изменения, которые сопровождают присоединение каждой последующей молекулы кислорода; Б– в результате изменения конформации активного центра возрастает сродство НЬ к кислороду, 4-я молекула кислорода присоединяется к оксигенированному гемоглобину [НЬ(О2)3] в 300 раз легче, чем 1-я
Рис. 1.24. Кривые насыщения миоглобина и гемоглобина кислородом
кислородом, высвобождаемым гемоглобином, и освобождение в случае интенсивной физической нагрузки.
Изменение сродства гемоглобина к О2 обеспечивает быстрое насыщение крови кислородом в легких, а также освобождение и передачу его в ткани. Миоглобин обладает более высоким сродством к О2, поэтому связывает и передает в митохондрии клеток кислород, транспортируемый НЬ в мышцы.
Гемоглобин доставляет в сутки до 600 л (850 г) О2 в ткани и способствует удалению из них ~ 500 л (1000 г) СО2. Движущей силой этих потоков является градиент концентраций О2 между альвеолярным воздухом и межклеточной жидкостью. Парциальное давление О2 в альвеолярном воздухе составляет 100 мм рт.ст. Парциальное давление О2
в тканях намного ниже (~ 40 мм рт.ст.), что обусловлено поступлением и использованием кислорода митохондриями клеток, где он превращается в Н2О. Таким образом О2 поглощается клетками.
Обмен О2 и СО2 происходит в капиллярах: в легких О2 переходит из альвеолярного воздуха в эритроциты, а СО2 – в обратном направлении; в капиллярах тканей О2 из эритроцитов перемещается в клетки тканей, а СО2 – в обратном направлении (рис. 1.25).
Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической регуляцией,а соединения-регуляторы –аллостерическими лигандами.Способность к аллостерической регуляции характерна, как правило, для олигомерных белков, т.е. для проявления аллостерического эффекта необходимо взаимодействие протомеров. При воздействии аллостерических лигандов белки меняют свою конформацию (в том числе и активного центра) и функцию.
Молекула гемоглобина способна связываться с несколькими лигандами: О2, Н+, СО2, 2,3-бис- фосфоглицератом (БФГ). Н+, СО2 и БФГ являются аллостерическими регуляторами активности гемоглобина и присоединяются к участкам (аллостерическим центрам), пространственно удаленным от активного центра.
Концентрация аллостерических лигандов снижает сродство гемоглобина к кислороду, а миоглобин и отдельные субъединицы гемоглобина нечувствительны к изменениям концентрации Н+, СО2 и БФГ, т.е. аллостерические свойства гемоглобина возникают только в результате взаимодействия субъединиц.
Рис. 1.25. Перенос кислорода и диоксида углерода гемоглобином. Эффект Бора
БФГ образуется из глюкозы в эритроцитах и является одним из регуляторов работы гемоглобина. Его молярная концентрация в крови близка к молярной концентрации НЬ. В центре молекулы гемоглобина полипептидные цепи 4 протомеров образуют полость (аллостерический центр), причем величина ее увеличивается в дезоксигемоглобине и уменьшается в оксигемоглобине. БФГ поступает в полость дезоксигемоглобина, связываясь с положительно заряженными группами на β-протомере (рис. 1.26). При этом его сродство к О2 снижается в 26 раз. В результате происходит высвобождение кислорода в капиллярах ткани при низком парциальном давлении О2.
Рис. 1.26. Связывание БФГ с дезоксигемоглобином
Центр связывания БФГ находится в положительно заряженной полости между 4 протомерами гемоглобина. Взаимодействие БФГ с центром связывания изменяет конформацию α- и β-протомеров НЬ и их активных центров. Сродство НЬ к молекулам О2 снижается и кислород высвобождается в ткани. В легких при высоком парциальном давлении О2 активные центры гемоглобина насыщаются за счет изменения конформации и БФГ вытесняется из аллостерического центра
В легких высокое парциальное давление О2, наоборот, приводит к оксигенированию НЬ и освобождению БФГ.
Содержание БФГ в крови человека соответствует содержанию гемоглобина и повышается при понижении содержания кислорода в воздухе (гипоксии) или затруднении дыхания при заболеваниях легких. Понижение его концентрации ухудшает снабжение тканей кислородом.
Это важно учитывать при переливании крови и сохранять необходимую концентрацию БФГ при консервации. Переливание донорской крови с пониженным содержанием БФГ может привести к гипоксии и гибели больных.
В регуляции работы гемоглобина основная роль принадлежит протонам Н+. • В тканиНЬ поступает преимущественно в виде НЬ(О2)4. Но при низком парциальном давлении О2 происходит отщепление части кислорода. Увеличение содержания не полностью оксигенированных форм НЬ облегчает высвобождение О2.
В мышцах образуется много СО2, который под действием карбоангидразы превращается в угольную кислоту Н2СО3, диссоциирующую на Н+ и бикарбонат-ион:
СО2 + Н2О → Н2СО3 → Н+ + НСО3-
Повышение концентрации Н+ вызывает протонирование ионогенных групп НЬ, что приводит к снижению его сродства к О2:
Н+ + НЬ О2 → Н+ НЬ + О2
Далее с дезоксигемоглобином взаимодействует
БФГ:
В легкиепоступает кровь с высоким содержанием дезоксигемоглобина, протонированного, связанного с БФГ или СО2. В такой форме гемоглобин имеет пониженное сродство к О2.
Из капилляров диффундирует СО2, освобождающийся в результате реакции:
Н+ + НСО-3 → Н2СО3 → СО2 + Н2О
Это стимулирует депротонирование гемоглобина:
Н+ НЬ → Н+ + НЬ
Высокое парциальное давление О2 приводит к оксигенированию НЬ, при этом вытесняется БФГ:
НЬ БФГ → НЬ + БФГ
Частичное оксигенирование гемоглобина повышает его сродство к кислороду, все реакции, приведенные выше, происходят в обратном порядке.
Зависимость сродства гемоглобина к кислороду от концентрации ионов водорода (Н+) получила названиеэффекта Борапо имени датского физиолога, изучавшего функционирование гемоглобина (см. рис. 1.25).
Таким образом, количество транспортируемого гемоглобином в ткани кислорода регулируется и повышается при увеличении содержания СО2 и Н+ в крови (например, при интенсивной физической работе); при сдвиге рН крови в щелочную сторону (алкалозе) доставка кислорода в ткани понижается.
