Железодефицитная анемия причины аплазия костного мозга

Апластическая анемия – это крайне неприятное заболевание, способное кроме проблем со здоровьем устроить и финансовые проблемы (лечение очень дорогое). Суть заболевания сводится к нарушению производства крови. На языке медицины – нарушается гемопоэз (кроветворение). Точнее – форменные элементы крови (лейкоциты, эритроциты, тромбоциты) либо производятся в недостаточном количестве, либо их производство прекращается вовсе.
Болезнь достаточно редкая. Сложность лечения связана с тем, что самым простым разделом кроме лекарственной является заместительная трансфузионная терапия эритроцитарной и/или тромбоцитарной массы. Для сложных случаев остается только пересадка костного мозга – дорогая, с целым рядом осложнений операция.
По статистике в зоне риска апластической анемии молодые люди до 20 лет (преобладает вирусная природа патологии), а также люди старше 65-ти лет (накопленные возрастные сбои биохимических процессов как причина).
Внимание. Болезнь имеет высокую летальность – превышает 80%.
Статистику можно посмотреть в видео в конце статьи.
Что такое апластическая анемия
Справочно. Апластическая анемия – это опасное заболевание, при котором нарушается образование клеток крови на уровне костного мозга.
В зависимости от степени выраженности угнетения кроветворения различают две формы:
- гипопластическая анемия (при этой форме функция кроветворения сохранена, но значительно снижена),
- апластическая анемия (полное угнетение кроветворения).
По сути они являются одним и тем же заболеванием разной степени выраженности. Нарушается продукция эритроцитов, тромбоцитов и лейкоцитов.
Клинические проявления могут быть разнообразными и на первых этапах напоминать общее недомогание за счет снижения эритроцитов – возникают слабость, головокружения, могут появиться обмороки.
За счет нехватки тромбоцитов развиваются кровотечения, кожные геморрагические высыпания.
Внимание. Сниженное содержание лейкоцитов в крови сказывается на развитии воспалительных процессов, включая гнойные.
Апластическая анемия – причины
Выделить единственную причину невозможно, так как вызвать апластическую анемию могут различные факторы. Они разительно отличаются друг от друга, но могут приводить к одинаково тяжелым последствиям.
Справочно. Выделяют два основных типа заболевания – врожденный и приобретенный. В первом случае ребенок первоначально содержит генную мутацию, которая приводит к нарушению кроветворной функции. Во втором варианте нарушение выработки клеток крови происходят под влиянием внутренних (эндогенных) или внешних (экзогенных) факторов.
Клиническая картина этих вариантов отличается. Во-первых, врожденные формы часто проявляются на ранних сроках жизни. Во-вторых, они могут сочетаться с аномалиями развития различных органов.
Внимание. В зависимости от вида хромосомной мутации, может наблюдаться снижение производства лишь одного вида кровяных клеток.
При манифестации во взрослом возрасте первыми симптомами могут быть общее недомогание и головокружение, которые являются неспецифичным и возникают при многих заболеваниях. Скорость прогрессирования апластической анемии зависит от выраженности нарушения кроветворной функции.
Апластическая анемия у детей (врожденная)
Врожденные формы включают в себя следующие варианты:
- Синдром Даймонда-Блекфена. При данной патологии происходит нарушение на уровне клеток-предшественников эритроцитов. Фенотипическим симптомом является бледная кожа. Увеличение печени и селезенки не характерно, но может развиваться с течением времени.
- Анемия Фанкони. Наследственное заболевание, которое проявляется на пятом десятке жизни. Возникает острый лейкоз и апластическая анемия. Для данной генной мутации характерны аномалии развития, которые проявляются уже на ранних сроках жизни. В основном это аномалии костной системы (низкий рост, маленький череп, недоразвитие первого пальца верхних конечностей, лучевой кости, тяжелая дисплазия бедра, дополнительное ребро) и неврологический дефицит (аномалии глазных яблок, косоглазие, птоз, нарушение слуха, умственные нарушения развития).
- Синдром Эстрена-Дамешека. Помимо нарушения кроветворения для данных детей характерна определенная внешность – светлые волосы, широко расставленные глаза, курносый нос. Апластическую анемию в этом варианте сопровождает увеличение печени и селезенки.
Приобретенная апластическая анемия
Приобретенные формы различают по факторам, которые вызывают апластическую анемию.
- Внешние (экзогенные) факторы:
- Медикаментозное влияние – прием сульфаниламидов, антибактериальных средств (тетрациклин, левомицитин, стрептомицин), средств для лечения туберкулеза (изониазид, ПАСК), анальгина, цитостатиков.
- Воздействие химических агентов – наиболее опасны нефтепродукты, бензольные производные, ртуть.
- Радиоактивное воздействие.
- Инфекции. Наиболее опасными являются вирус, вызывающий гепатит С, цитомегаловирус, герпес-вирус. Чаще всего они оказывают выраженное повреждающее действие лишь при активно перенесенном заболевании.
- Внутренние (эндогенные) факторы:
- Аутоиммунное поражение костного мозга. Чаще наблюдается в пожилом возрасте.
- Эндокринное влияние. Выявлена связь с нарушением функции щитовидной железы, и с заболеваниями яичников у женщин.
Внимание. Данное разделение условное, так как даже экзогенные факторы могут влиять на костный мозг опосредованно через запуск аутоиммунной агрессии.
Апластическая анемия – механизм развития
В настоящее время существует три теории, объясняющих механизм развития апластической анемии. Каждая из них получила подтверждение в ходе исследований.
Внимание. В некоторых случаях ни одна из имеющихся теорий не может объяснить возникновение заболевания. При таком варианте используют название «идиопатическая апластическая анемия».
Поэтому официально теории приняты, но изучение механизмов возникновения апластической анемии продолжается.
Теории патогенеза (возникновения) апластической анемии:
- аутоиммунная;
- стромальная;
- преждевременный апоптоз.
Аутоиммунная теория
Справочно. В аутоиммунной теории за основу берется развитие иммунного ответа к клеткам костного мозга.
Возникла она в результате исследования материала биоптата костного мозга после развития апластической анемии.
В большом количестве случаев ученые увидели присутствие клеточного иммунитета (моноциты, Т-киллеры), а также факторов воспаления – фактор некроза опухолей, интенферон альфа и гамма.
После более детального изучения стало понятно, что скапливаются они из-за генной мутации. В результате нарушения работы гена PIG-A возникает дефицит специального гликопротеина, который необходим для того, чтобы снижать активность системы комплемента, входящей в состав иммунной системы.
В результате этой поломки защита собственных клеток костного мозга слабеет, они начинают восприниматься, как чужеродные и развивается аутоиммунная реакция. В зависимости от количества поврежденных клеток степень выраженности симптомов разнится.
Важно. Чем больше вовлечено ткани, тем более агрессивная анемия наблюдается у пациента.
Стромальная теория
Нормальное функционирование механизма кроветворения во многом зависит от стромы, то есть специального соединительнотканного основания, в котором находятся клетки костного мозга.
Строма отвечает за выработку специальных веществ (интерлейкины и факторы стволовых клеток), которые необходимы для направления недифференцированных молодых клеток по пути образования эритроцитов, тромбоцитов или лейкоцитов.
Стимулируется эта выработка эритропоэтином.
В случае нарушения выделения факторов роста на уровне стромы возникают низкодифференцированные клетки, которые не могут выполнять свои функции. Они не достигают дифференцировки, достаточной для определения в крови при анализе.
Справочно. Подтверждается данная теория при биопсии костного мозга – определяются предшественники клеток в большом количестве. А также определяется повышенный уровень эритропоэтина в крови. Такие изменения характерны не более чем для 20% случаев.
Теория преждевременного апоптоза
Термином апоптоз в медицине обозначают естественный процесс гибели клетки, когда она в полном объеме выполнила свою функцию. Происходит это во всех тканях организма. После определенного времени клетки подвергаются мутации, начинают восприниматься организмом, как старые, и удаляются.
В норме процесс представляет собой защитный механизм, который способствует обновлению тканей. Мутировавшие клетки могут переродиться в опухолевый процесс, и функция апоптоза – не допустить этого. Однако, если этот процесс начинает происходить раньше времени, возможно чрезмерное удаление клеток ткани. При недостаточном синтезе новых клеток этот процесс приводит к нарушению функции.
Справочно. Причиной слишком раннего удаления здоровых и молодых клеток является мутация гена, отвечающего за выработку протеина Р-450.
Изучение механизмов развития апластической анемии до сих пор является зоной научных интересов исследователей всего мира. Однако это может внести вклад в лечение заболевания в будущем, но никак не сказывается на современных пациентах.
Дело в том, что на сегодняшний момент самым эффективным методом лечения апластической анемии остается пересадка костного мозга. Для замедления процесса используют стероидные гормоны.
Внимание. Ни один из методов лечения не учитывает патогенез процесса.
Апластическая анемия – симптомы
Учитывая угнетение выработки кровяных телец, выделяют следующие синдромы апластической анемии:
- Анемический (возникает за счет недостаточности эритроцитов и, соответственно, гемоглобина);
- Геморрагический (возникает в результате нехватки тромбоцитов, которые в норме останавливают кровотечение, образовывая тромботические массы);
- Токсико-инфекционный (недостаточность лейкоцитов – клеток иммунитета, в результате чего даже незначительная инфекция может развиться до гнойного процесса).
Клиническая картина каждого синдрома отличается. Может наблюдаться как сочетание всех синдромов, так и превалирование одного.
- При анемическом синдроме преобладают:
- повышенная утомляемость;
- головокружение;
- тошнота;
- одышка даже при минимальной нагрузке;
- тахикардия;
- потемнение в глазах.
- При геморрагическом:
- Множественные, легко образующиеся синяки;
- Излишне замедленная остановка любого кровотечения;
- Возникновение носовых кровотечений;
- Обильные месячные;
- Кровоточивость из десен;
- Возникновение специфических высыпаний – тромбоцитопеническая пурпура (является по факту пропитыванием кожи кровью).
- При токсико-инфекционном:
- Тяжелое течение легких инфекционных заболеваний;
- Медленное заживление ран, часто с нагноением.
Эти признаки более характеры для развития апластической анемии во взрослом возрасте. Эти пациенты могут анализировать свое состояние и предъявлять жалобы на приеме у врача.
Апластическая анемия у детей имеет свои особенности. При возникновении заболевания в совсем раннем возрасте они не могут объяснить свои ощущения, но существуют так называемые стигмы (или особенности), которые позволяют заподозрить различные наследственные формы анемии и провести генетическое тестирование.
Обычно у детей при наличии апластической анемии отмечаются следующие особенности:
- маленькая голова,
- укорочение первого пальца верхних конечностей,
- дисплазия тазобедренного сустава при синдроме Фанконе,
- специфический фенотип (светлые волосы, курносый нос, широко поставленные глаза при синдроме Эстрена-Дамешека),
- гепато- и спленомегалия.
Апластическая анемия – диагностика
Сбор жалоб и осмотр пациента является первым звеном в постановке диагноза и дает врачу первоначальный вектор для дальнейшего
подтверждения диагноза.
Самым важным этапом является инструментальная и лабораторная диагностика, которая включает в себя:
- Стернальную пункцию костного мозга;
- Трепанобиопсию;
- биохимический анализ крови;
- общий анализ крови.
Справочно. Стернальная пункция представляет собой забор материала из грудины с помощью специальной иглы. Элементы костного мозга помещают на стекла и изготавливают миелограмму, по которой могут сказать, какие клетки содержит костный мозг, соответствует ли их количественный и качественный состав норме.
С помощью трепанобиопсии производят забор костного мозга из крыла подвздошной кости. Данный метод помогает помимо анализа клеток (цитологического) провести гистологический анализ. Это помогает получить информацию о строме, ее представленности, а также соотношении желтого (неактивного) и красного костного мозга.
Биохимический анализ позволяет получить информацию о:
- содержании сывороточного железа (необходимо для подтверждения анемии),
- эритропоэтина (повышается при недостаточной выработке факторов роста стромой), – антителах к вирусам (которые могут быть причиной заболевания),
- С-реактивного белка (высокоспецифичный показатель воспалительного процесса).
Общий анализ крови показывает количественное содержание клеток крови (эритроциты, тромбоциты, лейкоциты), а также оценивает качественные характеристики клеток.
Апластическая анемия – лечение
На первых этапах апластическую анемию стараются лечить глюкокортикоидами и цитостатиками. Выбран данный метод в связи с преобладанием аутоиммунной агрессии по отношению к костному мозгу. Данный подход приносит положительные результаты, однако часто они являются временными.
Для симптоматического лечения синдромов могу применяться антибиотики, препараты для коррекции артериального давления, ферментные препараты.
Иммуносупрессивную терапию в качестве единственного лечения применяют лишь в начале апластической анемии. Далее стараются комбинировать с цитостатиками и препаратами для симптоматического лечения в зависимости от преобладания синдромов.
Справочно. На данный момент наиболее эффективным лечением апластической анемии является пересадка (трансплантация) костного мозга.
К сожалению, она не всегда проходит гладко. Выделяют несколько наиболее частых осложнений процедуры.
Осложнения пересадки костного мозга
К основным осложнениям относят следующие:
- инфекционные осложнения. Как и при любом оперативном вмешательстве существует риск нагноения места пункции. У пациентов с апластической анемией снижен иммунитет, поэтому даже при должном соблюдении правил асептики и антисептики не исключено появление данного осложнения.
- Отторжение трансплантата. Любой пересаженный орган воспринимается иммунными клетками организма, как чужеродный. Возникает иммунная реакция с попыткой уничтожить инородную ткань.
- Реакция трансплантата против организма пациента. При пересадке стволовых клеток возникает образование клеточного иммунитета донора. Новые клетки начинают агрессивно себя вести по отношению к лимфоцитам пациента. Этот процесс приводит к образованию высыпаний, нарушениями работы сердечно-сосудистой системы и желудочно-кишечного тракта.
- отказ работы жизненно важных органов. Возникает из-за массивного стресса, оказываемого на организм процессом пересадки костного мозга, а также приемом большого количества препаратов.
Несмотря на возможность тяжелых осложнений, трансплантация костного мозга остается самым эффективным методом лечением апластической анемии.
Справочно. Для минимизации рисков осложнений используются различные препараты до и после процедуры.
Апластическая анемия – прогноз
Врожденные формы часто сложнее поддаются лечению, так как костный мозг первоначально генетически не полноценен. Так, при анемии Фалкони, медикаментозное лечение протекает крайне сложно, а пересадка костного мозга может иметь противопоказания из-за аномалий развития.
Справочно. Приобретенные виды анемии легче поддаются лечению, особенно в случае устранения повреждающего фактора, если он был определен. Успех лечения во многом зависит и от времени выявления. Ранняя диагностика существенно повышает шансы на излечение.
Кроме того, выраженность симптомов может варьировать в зависимости от выраженности повреждения костного мозга. При медленно текущем процессе с минимальными повреждениями, даже медикаментозное лечение протекает легче и приносит существенное облегчение.
Аплазия костного мозга (аплазия кроветворения) – синдромы костномозговой недостаточности, которые характеризуются подавлением функций кроветворения. У пациентов наблюдается дефицит всех видов кровяных клеток: лейкоцитов, эритроцитов и тромбоцитов. Первопричина аплазии кроветворения выявляется с помощью лабораторных методов. Способы лечения зависят от болезни, которая вызвала патологию. В международной классификации болезней (МКБ-10) аплазия костного мозга обозначается кодом D61.
Что такое аплазия костного мозга?
Костный мозг – орган кроветворной системы, который содержит как стволовые, так и созревшие клетки крови. Уменьшение количества всех клеток крови из-за приобретенной (часто) или врожденной (редко) аплазии костного мозга называется апластической анемией. Врожденные формы включают анемию Фанкони и синдром Даймонда-Блекфена.
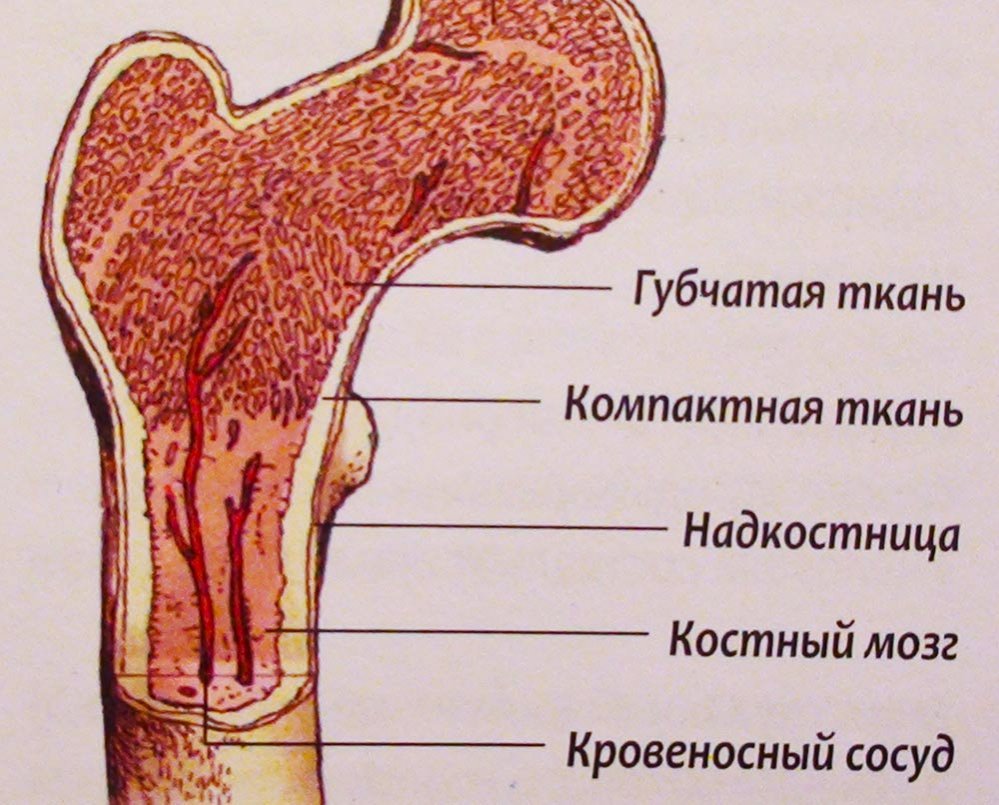
Аплазия костного мозга – состояние, при котором кроветворная функция костного мозга резко подавлена
Ежегодно возникает 0,2-0,3 случая на 100 000 человек. Около 200-300 человек в России страдают аплазией костного мозга. Болезнь опасна для жизни и отражается в измененной картине крови пациентов. Диагноз может затронуть даже здоровых молодых людей.
Если нарушается гемопоэз в костном мозге, могут образовываться дефектные кровяные клетки. Расстройство может затрагивать разные типы клеток (эритроциты, лейкоциты, тромбоциты). Симптомы аплазии кроветворной системы возникают потому, что количество клеток уменьшается настолько, что они не могут выполнять свою функцию в достаточной степени.
Классификация
По клиническому течению различают острую (до 1 месяца), подострую (от 1 до 6 месяцев) и хроническую форму (от полугода и дольше) заболевания. По тяжести грануло- и тромбоцитопении выделяют 3 степени:
- Легкую (тромбоцитов более 20х109/л, гранулоцитов – более 0,5х109/л).
- Тяжелую (тромбоцитов менее 20х109/л, гранулоцитов – менее 0,5х109/л).
- Очень тяжелую (тромбоцитов менее 20х109/л, гранулоцитов – менее 0,2х109/л).
Симптомы
Уменьшение концентрации эритроцитов вызывает слабость, усталость, одышку и учащенное сердцебиение, особенно во время физических нагрузок. У пациентов с анемией часто наблюдается бледность кожных покровов.

При аплазии костного мозга иммунная система снижается
Из-за уменьшения количества белых кровяных телец повышается восприимчивость к инфекционным заболеваниям. Поскольку иммунная система организма не может оптимально работать с уменьшенным количеством гранулоцитов, инфекция может привести к фатальным последствиям. Поэтому важно обратиться незамедлительно к врачу в таких ситуациях.
При уменьшенном количестве тромбоцитов нарушается свертывающая система крови. В результате возникают так называемые петехии – очень небольшое точечное кровотечение или кровоподтеки (гематома). Они также могут возникать спонтанно, без предварительной травмы. Даже относительно небольшое кровотечение или микротравма (например, при посещении стоматолога) может привести к летальному исходу.
Причины
По этиологии (причине возникновения) выделяют врожденную и приобретенную аплазию костного мозга.
Врожденная форма:
- Анемия Фанкони.
- Синдром Даймонда-Блекфена.
Приобретенная форма:
- Идиопатическая (>70% случаев).
- Лекарственная (10%): нестероидные противовоспалительные средства, хлорамфеникол, фенилбутазон, золото, пеницилламин, аллопуринол, фенитоин.
- Токсическая (10%).
- Вирусная (5%): особенно парвовирус B19 и вирус Эпштейна-Барр.
Поскольку во многих ситуациях фактор риска не может быть определен, большинство случаев заболевания следует классифицировать как идиопатические – без известной причины. Однако гипоплазия (или аплазия) костного мозга также может возникать как часть аутоиммунного заболевания, такого как системная красная волчанка.
Известно, что ряд цитотоксических препаратов увеличивает риск развития гипоплазии в области костного мозга. Следует отметить, что антиметаболиты вызывают только острую аплазию, тогда как алкилирующие вещества – хроническую.
Опасные осложнения
Гипоплазия, как и аплазия, костного мозга может протекать остро или хронически. Первыми предупредительными признаками могут быть нейтропения и тромбоцитопения. Иногда возникают клинические признаки анемии: усталость, общее чувство слабости, бледность кожи и слизистых оболочек. При хронической форме развиваются инфекции в области рта и шеи. Иногда увеличивается склонность к кровотечениям.
Диагностика
При физикальном осмотре больного определяют частоту пульса, так как при аплазии чаще всего он учащен
Вначале врач собирает анамнез, а затем проводит физический осмотр пациента. При подозрении на аплазию костного мозга назначают следующие обследования:
- Анализ крови.
- Гистологическое исследование.
- Цитогенетическое исследование.
При микроскопическом анализе выявляются «пустоты» в костном мозге. Это означает, что гемопоэтические клетки, которые содержатся у здоровых людей, отсутствуют и частично заменены жировыми клетками у пациентов с аплазией кроветворной системы.
Однако значительное снижение таких клеток также наблюдается при других заболеваниях. Врожденная недостаточность костного мозга или миелодиспластический синдром – распространенные причины гипоплазии кроветворной системы. Поэтому необходимы дальнейшие исследования, чтобы подтвердить диагноз.
Чтобы исключить лейкоз или миелодиспластический синдром и другие причины, может потребоваться цитогенетическое исследование. Возможные отклонения в количестве, а также в структуре хромосом могут быть обнаружены с помощью этого метода исследования. Приобретенная форма болезни обычно не характеризуется дефектами генетического материала. Выявление изменений в хромосомах, скорее всего, указывает на наличие миелодиспластического синдрома.
Лечение
Если известен фактор, вызывающий анемию – излучение, химические вещества, лекарства, – рекомендуется его устранить. Лечение зависит от тяжести заболевания. Терапия тяжелой и очень тяжелой аплазии кроветворной системы не отличается.
При легкой форме аплазии рекомендуется выжидательная терапия: пациент должен регулярно посещать врача и проходить плановые обследования. Ожидаемая продолжительность жизни этих пациентов не уменьшается даже при отсутствии лечения.
Болезнь была смертельной в XX веке. Сегодня аплазию можно вылечить трансплантацией стволовых клеток. Если донора нет, иммунодепрессанты могут остановить разрушение костного мозга.
При тяжелой и очень тяжелой аплазии костного мозга назначают следующие терапевтические меры:
- Трансплантация гемопоэтических стволовых клеток.
- Иммунодепрессивная терапия.
- Поддерживающая терапия.
Если имеется донор в семье (например, братья и сестры), пересадку костного мозга следует выполнить как можно скорее. Длительное ожидание перед трансплантацией и большое количество переливаний крови могут ухудшить исходное состояние пациента. Если не найдено подходящего донора, назначается иммунодепрессивная терапия. Предварительное планирование лечения в специализированном центре абсолютно необходимо при аплазии костного мозга.
При аллогенной трансплантации пациент получает стволовые клетки крови от другого человека. Предшественники клеток крови могут принадлежать родственнику или незнакомцу. Аллогенная пересадка незнакомого донора связана с относительно более высокими рисками из-за низкой совместимости тканей.
Иммуносупрессивная терапия

Иммуносупрессивное лечение проводится, если нельзя провести трансплантацию
Если подходящий донор не найден, рекомендуется проведение иммуносупрессивной терапии. В этом случае комбинация нескольких препаратов подавляет дефектную иммунную реакцию, которая привела к уменьшению кроветворных клеток в костном мозге.
В последние годы назначают комбинацию антитимоцитарного глобулина и циклоспорина. В течение первых 4 дней стационарного лечения антитимоцитарный глобулин вводят через вену. Кроме того, пациенты получают в течение 4 недель глюкокортикоидное средство. Как только у пациента улучшается самочувствие и показатели крови, его можно отпустить домой и давать лекарства в виде таблетки или жидкости.
После иммунодепрессивной терапии у около 30% пациентов возникает рецидив болезни. У около 20% пациентов развивается острый миелоидный лейкоз или пароксизмальная ночная гемоглобинурия. Если в первые 3-6 месяцев после введения препаратов не наблюдается заметного улучшения состава крови или после успешной терапии апластическая анемия снова рецидивирует, необходима трансплантация стволовых клеток. Повторная иммуносупрессивная терапия, как правило, не проводится.
Поддерживающая терапия
В зависимости от типа лечения (трансплантация костного мозга или применение иммунодепрессивных препаратов) требуется использовать различные поддерживающие меры, которые помогают бороться с побочными эффектами или осложнениями болезни. Иногда назначают симптоматические средства для уменьшения усталости.
Прогноз
Шансы на выздоровление пациента при своевременно начатом лечении достаточно высокие, хотя это опасное для жизни состояние. Аллогенная трансплантация гемопоэтических стволовых клеток приводит к выздоровлению 80-90% пациентов с гипоплазией в области костного мозга. Пересадка клеток от незнакомого донора также может вылечить пациентов с заболеваниями костного мозга. Однако у многих детей и подростков (около 20-30%) по-прежнему развиваются серьезные, а иногда и фатальные осложнения.
После завершения трансплантации пациенты должны обследоваться не реже одного раза в год у специалиста. Плановые обследования помогают своевременно лечить и предотвращать долгосрочные осложнения.
При возникновении симптомов анемии пациент в обязательном порядке должен обращаться за консультацией квалифицированного специалиста. Категорически запрещено заниматься самолечением, поскольку это может привести к непредсказуемым последствиям. Важно не откладывать визит к врачу и своевременно проходить плановые обследования, чтобы избежать осложнений.
