Беременность и анемия статистика

Железодефицитная анемия — одно из тех редких осложнений беременности, которое можно легко предотвратить на этапе планирования. Даже здоровые беременные подвержены риску развития анемии в связи с физиологической гемодилюцией и расходованием запасов железа для роста плода и материнского эритропоэза [1]. Учитывая тот факт, что развивающийся плод очень требователен к концентрации кислорода и железа в поступающей к нему крови, плацента способна увеличивать количество рецепторов к железу и хранить его в резидентных ретикулоэндотелиальных клетках [1,3]. Следует различать дефицит железа и железодефицитную анемию (ЖДА). Распределение железа в организме идет преимущественно в пользу гемового железа, следовательно, развитие анемии на фоне железодефицита — это сигнал о выраженном недостатке микроэлемента в депо [3]. В связи с этим выделяют три стадии дефицита: предлатентный — снижение резервного железа без уменьшения расходования его на эритропоэз, латентный — истощение депо и дефицит транспортного железа, без признаков анемии и манифестный или ЖДА [8].
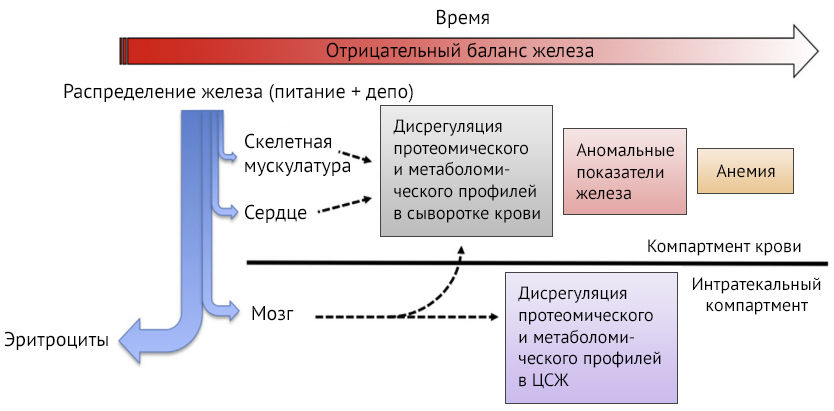
Рисунок 1 | Изменения в организме на различных стадиях железодефицита. Синей стрелкой указано распределение поступающего в организм железа — в первую очередь на эритропоэз, затем на синтез миоглобина и ферментные системы. Красной стрелкой указано прогрессирование дефицита с течением времени [3].
Потребность в железе на разных сроках беременности варьирует. В первом триместре суточная потребность снижается по сравнению с небеременным состоянием преимущественно за счет отсутствия менструальной кровопотери, а также за счет снижения эритропоэза. Во втором триместре объем циркулирующей крови увеличивается на 45 %, объем плазмы — на 50 %, а масса эритроцитов — на 35 %, следовательно, потребность в железе растет. В третьем триместре максимально возрастает потребность плода в железе, а кровопотеря в процессе родов уносит с собой около 150 мг железа [4].
Таблица 1 | Среднее увеличение потребности в железе в период беременности и в послеродовом периоде для женщин с массой тела до беременности от 55 до 60 кг [4,9]

Факторы риска развития железодефицита и железодефицитной анемии у женщин детородного возраста [4,8]:
- нарушения диеты (вегетарианство или веганство, недостаточное употребление красного мяса, анорексия, булимия, чрезмерное употребление кальция, чая, кофе);
- нарушения всасывания питательных веществ (болезнь Крона, целиакия);
- паразитозы (анкилостомоз, лямблиоз, цестодоз, шистосомоз);
- хронические заболевания (малярия, ВИЧ, гемоглобинопатии, аутоиммунные заболевания, ЗНО);
- осложнения беременности (рвота беременных, преэклампсия, холестатический гепатоз);
- короткие интервалы между беременностями (менее года);
- меноррагия;
- донорство крови.
Проявления дефицита крайне неспецифичны и могут списываться женщиной на саму беременность: быстрая утомляемость, слабость, раздражительность, нарушение концентрации внимания, бледность кожи и слизистых, головная боль, головокружение, тахикардия, одышка, усталость в ногах. Некоторые женщины отмечают пристрастие к специфическим продуктам: сырому мясу, сырым крупам, мелу, почве [1,8,10].
Существуют определенные опасности, связанные с дефицитом железа: повышение риска послеродовой депрессии, послеродового кровотечения (предположительно из-за снижения сократительной способности матки в условиях дефицита кислорода в тканях), некоторые исследования также говорят о риске развития послеродового сепсиса [1,10]. Женщин с анемией чаще подвергают гемотрансфузиям и родоразрешают путем кесарева сечения [2]. Преимущественно в странах с низким уровнем доходов показатели гемоглобина < 70 г/л связаны с двукратным увеличением материнской смертности [1,10]. В послеродовом периоде анемия связана с повышенной утомляемостью, депрессивными расстройствами, снижением познавательных способностей, нарушением лактации и ранним прекращением грудного вскармливания [10].
Железо в организме плода делится на гемовое железо, негемовое железо и депо, находящееся преимущественно в печени. В эритроцитах содержится 55 мг/кг железа в виде гемоглобина, нормальная концентрация которого у доношенных детей составляет 133–184 г/л. В депо хранится около 12 мг/кг железа в виде ферритина, нормальная концентрация которого в пуповинной крови доношенного ребенка составляет 170 мг/л. Наименьшее количество железа (около 8 мг/кг) участвует в метаболических процессах и переносе кислорода в мышцах. Дефицит негемового железа трудно отследить из-за отсутствия специфических биомаркеров, лабораторно он обнаруживается только в совокупности с дефицитом железа в депо и, как следствие, сниженным ферритином. Концентрация ферритина < 76 мг/л связана с нарушением неврологических функций новорожденного [3]. В случае легкой и умеренной степени дефицита у матери, компенсаторные механизмы поддерживают адекватное поступление железа плоду, но тяжелый дефицит, приводящий к развитию ЖДА у матери, приводит к развитию железодефицита у ребенка [5].
Регуляция биодоступности железа во время беременности, частично зависит от концентрации гепсидина у матери. Гепсидин – гормон-регулятор, вырабатывающийся в печени и регулирующий концентрацию железа в плазме и распределение его в тканях. Гепсидин действует путем ингибирования поступления железа в кровь, влияя на абсорбцию в кишечнике, высвобождение железа из макрофагов и мобилизацию его из депо. Гормон действует через рецептор ферропортин (Fpn), экспрессирующийся во всех тканях экспортирующих железо в плазму. Связывание гепсидина и ферропортина запускает секвестрацию железа в клетках-мишенях и снижение его поступления в плазму, следовательно, существует обратная зависимость между концентрацией гепсидина и достаточным потреблением железа тканями, в том числе костным мозгом и плацентой [9].
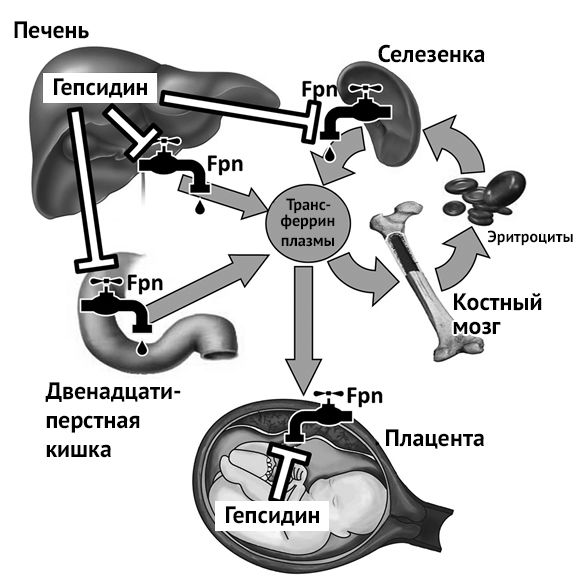
Рисунок 2 | Регуляция гомеостаза железа в организме беременной женщины. Fpn — ферропортин, Fe-Tf — трансферрин
В отношении влияния на развитие плода и исходы для новорожденного все не так однозначно: считается, что анемия матери связана с более высоким риском перинатальной и неонатальной смертности, низкой массой тела при рождении, преждевременными родами, однако метаанализ рандомизированных клинических исследований по влиянию добавок железа на перинатальные исходы показал лишь умеренное влияние на массу тела при рождении и неопределенное влияние на частоту преждевременных родов [1,2]. В то же время, некоторые исследования сообщают о 30% увеличении риска развития задержки роста плода на каждые 10 г/л сниженного гемоглобина до 20 недель беременности, а снижение гемоглобина <100 г/л значительно увеличивало риск мертворождения и перинатальной смерти. [10]. Постнатальный дефицит железа течение первых девяти месяцев в значительной степени обусловлен уровнем железа при рождении, следовательно, существует прямая зависимость между железодефицитом матери и плода. Самые распространенные факторы развития анемии у плода: острое материнское или плацентарное кровотечение и тяжелый дефицит железа у плода (менее 90 г/л). К другим факторам, приводящим к железодефициту плода, относятся артериальная гипертензия у матери, курение, нарушенная толерантность к глюкозе / сахарный диабет при нормальных показателях гемоглобина и ферритина, а также многоплодная беременность [3].
Наибольший интерес представляет влияние дефицита железа на нейрокогнитивные функции ребенка. Недостаток железа у матери в третьем триместре приводит к структурным изменениям головного мозга новорожденного, включая изменения в сером веществе: нейроны имеют более простую структуру, нарушается функционирование митохондрий. Железосодержащие ферменты играют важную роль в синтезе жирных кислот, являющихся неотъемлемой частью миелина, в связи с чем, дефицит железа в раннем возрасте изменяет жировой состав миелина и приводит к гипо- и дисмиелинизации нервной системы. Железодефицит изменяет экспрессию генов, критических для развития и функционирования гиппокампа, а также изменяет концентрацию нейротрансмиттеров, зависящих от железосодержащих гидроксилаз – тирозингидроксилазы и триптофангидроксилазы (дофамин, серотонин, норэпинефрин), нарушает работу их рецепторов и механизмов обратного захвата, что неминуемо приводит к ряду психоневрологических расстройств. [3,10].
У новорожденных с неанемическим дефицитом железа и концентрацией ферритина пуповинной сыворотки < 40 мг/л отмечаются нарушения памяти распознавания (способности узнавать ранее встречающихся людей, события, объекты), как и у двухмесячных младенцев с концентрацией ферритина пуповинной сыворотки < 76 мг/л. Нарушения памяти распознавания отмечались также в возрасте до 3,5–4 лет у детей с низким неонатальным уровнем железа, даже если в постнатальном периоде дефицита не было. Учитывая тот факт, что железодефицитная анемия у матери является предрасполагающим фактором для развития железодефицита у младенцев, создаются предпосылки для нарушения психомоторного развития ребенка. Дефицит железа в младенчестве и детстве связан с более низкой скоростью обработки информации, нарушением неврологических рефлексов, ухудшением двигательной функции, трудностями с социализацией, что в свою очередь создает предпосылки для развития тревожных и депрессивных расстройств в будущем. У детей в возрасте 5–6 лет отмечаются трудности с обучением, планированием и концентрацией внимания [3,10].
Существуют определенные риски, связанные с развитием психических расстройств у детей, рожденных от матерей с железодефицитной анемией. Низкий уровень железа в преконцепционном периоде связывают с высоким риском развития аутизма, во втором триместре — с повышением риска развития шизофрении на 30 % [3].
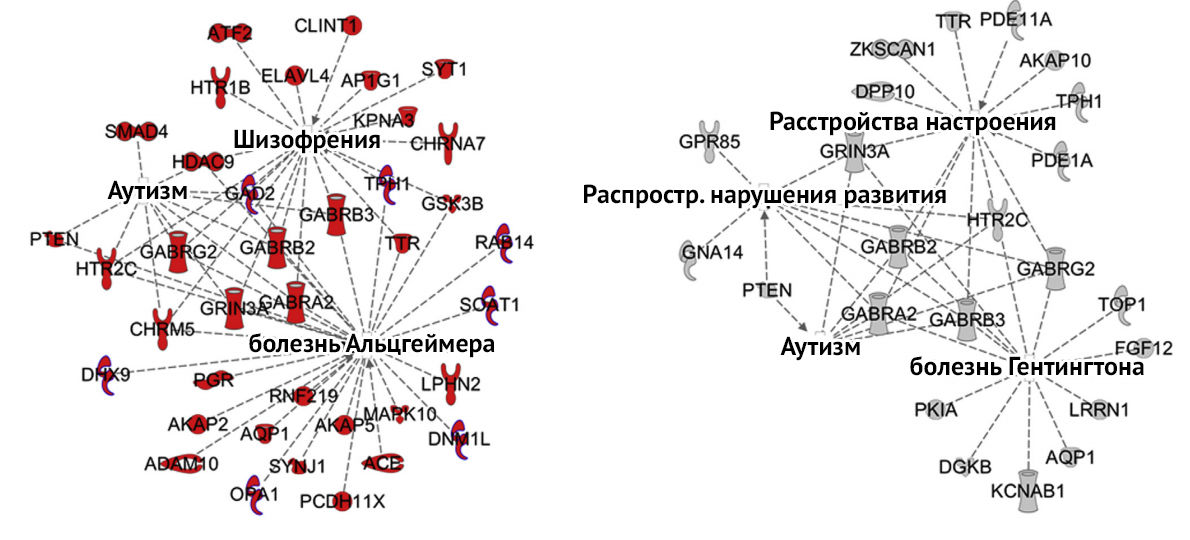
Рисунок 3 | Изменения экспрессии генов при железодефиците. Слева – непосредственное влияние дефицита на экспрессию, справа – эпигенетические нарушения. [3]
Как правило, железодефицит наряду с другими анемиями диагностируется во время рутинного исследования уровня гемоглобина в рамках общего анализа крови. Диагностика анемии у беременных имеет некоторые особенности в связи с вариабельностью показателей гемоглобина в зависимости от триместра. Для первого триместра пороговым значением является Hb < 110 г/л, для второго – < 105 г/л, в послеродовом периоде – < 100 г/л. В развернутом анализе крови рассчитываются эритроцитарные индексы: МНС (среднее количество гемоглобина в эритроците), MCV (средний объем эритроцита), МСНС (средняя концентрация гемоглобина в эритроците). Для дефицита характерно снижение показателей, однако, следует помнить о физиологическом увеличении MCV в время беременности [1,6].
Для железа существуют специфические маркеры: ферритин, различные методы оценки насыщения трансферрина: трансферрин, уровень растворимых рецепторов трансферрина (sTSAT), %TSAT (коэффициент насыщения трансферрина) и гепсидин – пептидный гормон, реагирующий на избыток железа. Концентрация гемоглобина в ретикулоцитах также определяет преанемию, дефицит железа и, следовательно, может служить ранним биомаркером дефицита железа [3,5]. Сывороточное железо и общая железосвязывающая способность сыворотки в настоящее время считаются ненадежными маркерами в связи с влиянием употребления железа и суточными колебаниями значений [6].
Таблица 2 | Диагностические критерии железодефицитной анемии у беременных. ПДЖ – предлатентный дефицит железа, ЛДЖ – латентный дефицит железа, МДЖ – манифестный дефицит железа. [7,8]
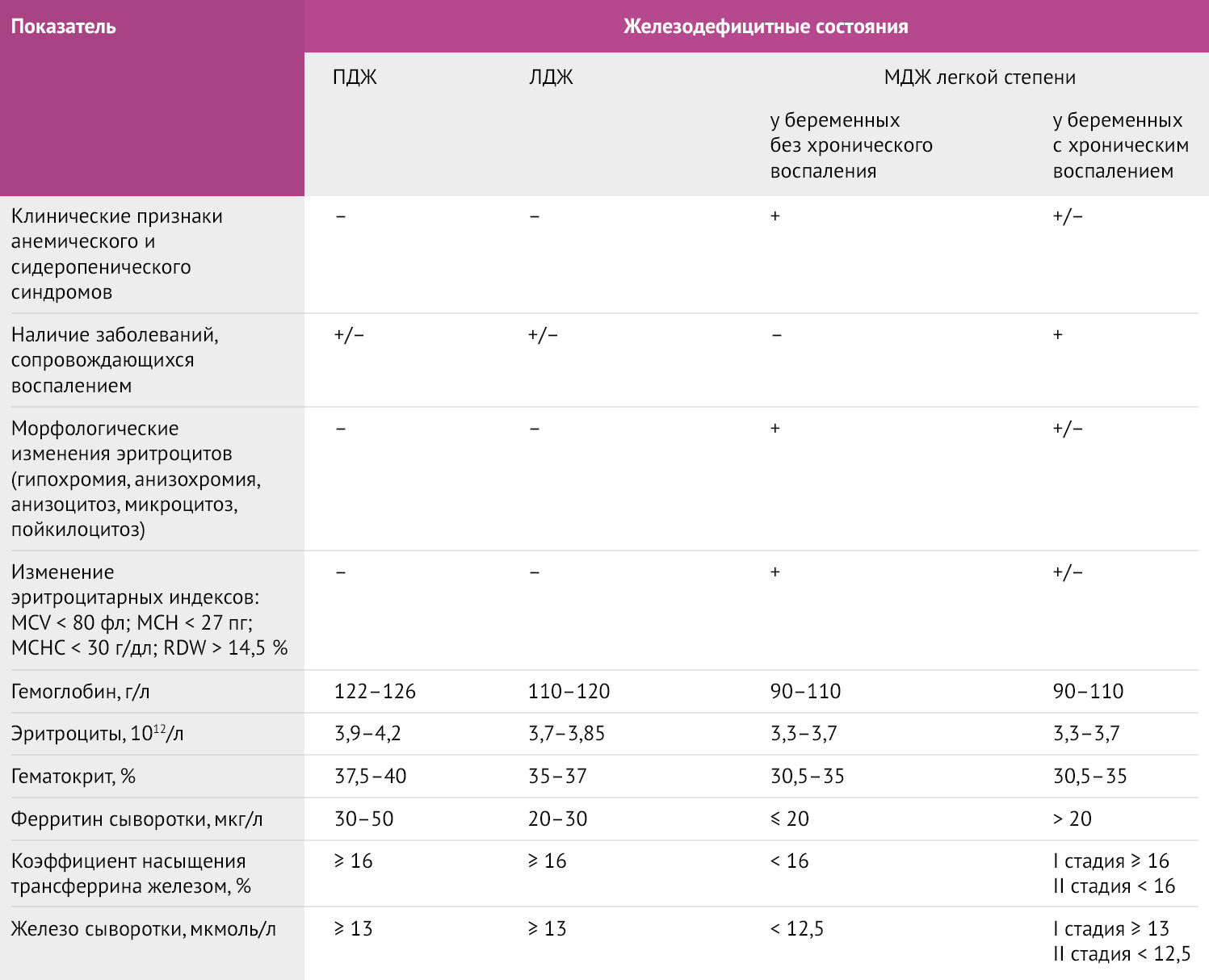
Наиболее широко у беременных используется ферритин – маркер депонирования железа в печени матери и плаценте. Именно ферритин поддерживает стабильный уровень железа, выводя из депо необходимое для синтеза гема количество. Диагностически значимым является снижение уровня сывороточного ферритина <30 мкг/л. Но в случае с сопутствующим системным воспалением ферритин может сыграть злую диагностическую шутку: уровень маркера растет, маскируя железодефицит, в связи с чем рекомендуется параллельное исследование С-реактивного белка для проведения дифференциальной диагностики [1,3,6].
Трансферрин — белок, отвечающий за транспорт железа в плазме крови, реагирующий на его дефицит увеличением концентрации. Показатель sTfR пропорционален количеству трансферрина. При снижении концентрации сывороточного железа концентрация sTfR возрастает одновременно с трансферрином. %TSAT рассчитывается путем деления уровня сывороточного железа на общую железосвязывающую способность сыворотки и умножения на 100. Он отражает процент участков связывания железа на трансферрине, которые заняты молекулами железа. Концентрация железа в сыворотке снижается на ранних этапах дефицита, тем самым снижая %TSAT. По мере усугубления дефицита концентрация трансферрина увеличивается, чтобы оптимизировать способность связывать железо для транспорта, что еще больше снижает %TSAT. Все эти изменения происходят до микроцитоза или анемии [3].
Самый интересный из предлагаемых маркеров — гепсидин, измерение концентраций которого в сыворотке может дать наибольшее количество информации о том, кто должен получать добавки железа, а кому они не показаны. Гепсидин — это главный регулятор всасывания железа в кишечнике и распределения железа из ретикулоэндотелиальных клеток, он синтезируется печенью в ответ на уровень железа и наличие воспаления. Гепсидин является негативным регулятором: это означает, что высокие его концентрации снижают всасывание железа в кишечнике и способствуют секвестрации железа, тогда как низкие уровни увеличивают абсорбцию железа в кишечнике и высвобождение железа ретикулоэндотелиальными клетками. Пациентки с низким уровнем гепсидина, вероятно, будут нуждаться в добавках железа и ответят на терапию, тогда как пациентки с высоким уровнем гепсидина из-за недостаточности железа или перегрузки им не нуждаются в дополнительном железе и не будут столь активно усваивать железо из пищи. Начало беременности характеризуется очень низкими концентрациями гепсидина, что указывает на состояние отрицательного баланса железа и дает веские доказательства того, что потребности в железе во время беременности высоки. Таким образом, женщины, уровень железа которых до беременности нормален или находится на границе нормы, склонны к развитию дефицита железа во время беременности [3].
- Pavord S. et al. UK guidelines on the management of iron deficiency in pregnancy //Br J Haematol. – 2019.
- Stanley L Schrier, Michael Auerbach. Treatment of iron deficiency anemia in adults//UpToDate, Feb. – 2018.
- Georgieff M. K. Iron deficiency in pregnancy //American journal of obstetrics and gynecology. – 2020.
- McMahon L. P. Iron deficiency in pregnancy //Obstetric Medicine. – 2010.
- McCann S., Perapoch Amadó M., Moore S. E. The Role of Iron in Brain Development: A Systematic Review //Nutrients. – 2020.
- Клинические рекомендации “Кровесберегающие технологии в акушерской практике” 2014.
- Федеральные клинические рекомендации “Диагностика, профилактика и лечение железодефицитных состояний у беременных и родильниц” 2013.
- Доброхотова Ю. Э., Бахарева И. В. Железодефицитная анемия беременных: профилактика и лечение //РМЖ. – 2018.
- Fisher A. L., Nemeth E. Iron homeostasis during pregnancy //The American journal of clinical nutrition. – 2017.
- Benson C. S. et al. Iron deficiency anaemia in pregnancy: A contemporary review //Obstetric Medicine. – 2020.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Введение
Анемия – патологическое состояние, характеризующееся уменьшением концентрации гемоглобина и, в подавляющем большинстве случаев, числа эритроцитов в единице объема крови. Частота анемии у беременных колеблется от 15 до 30% и, по данным Минздрава России, за последние 10 лет увеличилась в 6,3 раза, причем наиболее распространенной является железодефицитная анемия (ЖДА), на ее долю приходится около 90% от всех анемий [1]. Синдром ЖДА характеризуется ослаблением эритропоэза из-за дефицита железа вследствие несоответствия между поступлением и расходом (потреблением, потерей) железа, снижением наполнения гемоглобина железом с последующим уменьшением содержания гемоглобина в эритроците [2].
В соответствии с МКБ 10-го пересмотра учитывают следующие формы анемий, связанных с дефицитом железа:
D50 – железодефицитная анемия (асидеротическая, сидеропеническая, гипохромная);
D50.0 – железодефицитная анемия, связанная с хронической кровопотерей (хроническая постгеморрагическая анемия);
D50.1 – сидеропеническая дисфагия (синдромы Келли – Паттерсона и Пламмера – Винсона);
D50.8 – другие железодефицитные анемии;
D50.9 – железодефицитная анемия неуточненная.
ЖДА – нарушение, при котором снижается содержание железа в сыворотке крови, в костном мозге и депо, что приводит к нарушению образования гемоглобина, эритроцитов, возникновению анемий и трофических расстройств в тканях.
ЖДА занимают одно из ведущих мест в структуре экстрагенитальной заболеваемости беременных, т. к. во время беременности потребность в железе резко увеличивается вследствие высокой потребности в нем плаценты и плода, и возникает дисбаланс поступления и потребности необходимого микроэлемента. Согласно современным данным, дефицит железа в конце гестационного процесса развивается у всех без исключения беременных [2].
В организме человека содержится около 4 г железа: основная часть его (75%) входит в состав гемоглобина, меньшая часть входит в состав миоглобина (3,5%) и тканевых ферментов (0,5%), а также депонируется в печени и селезенке в виде ферритина и гемосидерина. Часть ферритина присутствует в плазме, а его концентрация служит индикатором запасов железа в организме [3].
Во время беременности потребность в железе неуклонно увеличивается (I триместр – на 1 мг/сут, II триместр – на 2 мг/сут, III триместр – на 3–5 мг/сут). Для выработки дополнительного железа используется 300–540 мг этого элемента. У большинства женщин к 28–30-недельному сроку физиологически протекающей беременности развивается анемия, связанная с неравномерным увеличением объема циркулирующей плазмы крови и объема эритроцитов. В результате показатель гематокрита снижается с 0,4 до 0,32, количество эритроцитов уменьшается с 4 до 3,5×1012/л, концентрация гемоглобина также снижается со 140 до 110 г/л (от I до III триместра). Подобные изменения картины красной крови, как правило, не отражаются на состоянии и самочувствии беременной. Истинная анемия беременных сопровождается типичной клинической картиной и оказывает влияние на течение беременности и родов. По сравнению с анемией, развившейся до беременности, анемия беременных протекает тяжелее, поскольку представляет собой осложнение, подобное гестозу. При наличии у женщины анемии, возникшей до наступления беременности, организм, как правило, успевает адаптироваться [3]. Суммарная потеря железа к окончанию беременности составляет примерно 1000–1200 мг. Процесс всасывания железа на протяжении беременности усиливается и составляет в I триместре 0,6–0,8 мг/сут, во II триместре – 2,8–3,0 мг/сут, в III триместре – до 3,5–4,0 мг/сут [4, 5]. Однако это не компенсирует повышенный расход элемента во время беременности. Более того, уровень депонированного железа у 100% беременных к концу гестационного периода снижается. Для восстановления запасов железа, потраченного в период беременности, родов и лактации, требуется не менее 2–3-х лет [6].
Биологическая значимость железа определяется его участием в тканевом дыхании. При дефиците железа у беременных возникает прогрессирующая гемическая гипоксия с последующим развитием вторичных метаболических расстройств. Поскольку при беременности потребление кислорода увеличивается на 15–33%, это усугубляет развитие гипоксии [4, 7].
ЖДА характеризуется нарушениями белкового обмена с возникновением дефицита белков в организме, что приводит к развитию отеков у беременной. При ЖДА развиваются дистрофические процессы в матке и плаценте, которые ведут к нарушению функции и формированию плацентарной недостаточности, у 10–15% отмечаются гипотония и слабость родовой деятельности. При этом развивающийся плод не получает в достаточном количестве полагающиеся ему питательные вещества и кислород, вследствие чего возникает задержка роста плода. Основными осложнениями беременности при ЖДА являются: угроза прерывания беременности (20–42%); гестоз (40%); артериальная гипотония (40%); преждевременная отслойка плаценты (25–35%); задержка роста плода (25%); преждевременные роды (11–42%). Роды часто осложняются кровотечениями. В послеродовом периоде могут возникать различные воспалительные осложнения (12%) [3, 5]. Даже при скрытом дефиците железа у 59% женщин отмечено неблагоприятное течение беременности в виде угрозы ее прерывания и гестоза [2, 5].
Одним из основных критериев ЖДА служит уровень гемоглобина, экспертами ВОЗ принята классификация анемии у беременных по концентрации гемоглобина (Hb) в крови:
• анемия легкой степени тяжести – концентрация Hb в крови от 90 до 110 г/л;
• умеренно выраженная анемия – концентрация Hb в крови от 89 до 70 г/л;
• тяжелая анемия – концентрация Hb в крови < 70 г/л.
Также к диагностическим критериям ЖДА относятся: цветовой показатель – < 0,85, микро- и анизоцитоз; средний диаметр эритроцитов – < 6,5 мкм; общая железосвязывающая способность сыворотки – > 64,4 мкмоль/л; сывороточное железо – < 12,6 мкмоль/л и уровень сывороточного ферритина (в норме 32–35 мкг/л), который служит индикатором дефицита железа в организме (≤ 12 мкг/л).
Для лечения ЖДА необходимы сбалансированная диета и назначение железосодержащих препаратов.
Cогласно Национальным рекомендациям «Клинические рекомендации (протоколы лечения) – железодефицитная анемия» (2015 г.), терапия железодефицитных состояний требует комплексного подхода, который включает коррекцию питания, применение лекарственных средств, строго соответствующих определенному патогенетическому варианту анемии, использование преимущественно препаратов орального применения, адекватно высокие суточные дозы одного препарата с хорошей переносимостью. Возможно назначение трансфузии эритроцитов по жизненным показаниям. Оценивают эффект лечения по клинико-лабораторным признакам, в т. ч. по ретикулоцитарному кризу [8].
В первую половину беременности рекомендуется суточный рацион, состоящий из 110 г белков, 80 г жиров и 350–400 г углеводов. Общая энергетическая ценность суточного рациона должна составлять 2600–2800 ккал. Во вторую половину беременности количество белков должно быть увеличено до 125 г, жиров – до 70–90 г, углеводов – до 400–420 г, калорийность питания составляет в этом случае 2900–3050 ккал. Таким образом, в физиологических условиях коррекция рациона может обеспечивать потребности организма в железе и предупреждать развитие железодефицитных состояний.
Однако, учитывая тот факт, что из пищи всасывается 2,5 мг железа в сутки, а из лекарственных препаратов – в 15–20 раз больше, необходима дотация железа лекарственными препаратами.
Рекомендуется назначение препаратов, содержащих Fe2+, FeSO4, из-за их лучшей абсорбции. Суточная доза для профилактики анемии и лечения легкой формы заболевания – 50–60 мг Fe2+, а для лечения выраженной анемии – 100–120 мг Fe2+. Железа сульфат назначают внутрь по 320 мг (соответствует 100 мг Fe2+) 2 р./сут строго за 1 ч до или через 2 ч после еды, т. к. на абсорбцию влияют различные ингредиенты пищи.
Наиболее предпочтительным является прием препаратов железа внутрь, а не в виде инъекций, т. к. в последнем случае чаще могут возникать различные побочные эффекты: запор, вздутие живота, понос, изжога, боли в желудке, тошнота, темный стул.
Причинами неэффективной терапии препаратами железа могут быть:
1) отсутствие ЖДА;
2) недостаточная доза лекарства;
3) недостаточная длительность лечения;
4) нарушение всасывания в кишечнике;
5) одновременный прием препаратов, уменьшающих всасывание железа;
6) имеющаяся незначительная кровопотеря (геморрой и пр.).
Из лекарственной формы всасывается не более 10–12% содержащегося в ней железа. При тяжелой степени дефицита железа показатель всасываемости железа может возрастать до 3-х раз. Повышению биодоступности железа способствуют присутствие аскорбиновой и янтарной кислот, фруктозы, цистеина и других акселераторов, а также использование в ряде препаратов специальных матриц, замедляющих высвобождение железа в кишечнике [3, 4].
Расчет суточного количества препарата (СКП) для пероральных препаратов железа выполняют по следующей формуле:
СКП = НСД/СЖП
где НСД – необходимая суточная доза двухвалентного или трехвалентного (не элементарного) железа (у взрослых – 200 мг/сут, у детей – 30–100 мг/сут);
СЖП – содержание двухвалентного или трехвалентного (не элементарного) железа в единице препарата (таблетке, капсуле, капле раствора, миллилитре сиропа или раствора) [5].
Расчет ориентировочной курсовой дозы препарата железа, назначаемого парентерально, может быть произведен по формуле с учетом массы тела больного и уровня гемоглобина, отражающего степень дефицита железа:
А=М(Hb1–Hb2) × 0,24+D,
где A – количество железа в мг;
M – масса тела в кг;
Hb1 – нормативная величина гемоглобина для массы тела < 35 кг – 130 г/л, > 35 кг – 150 г/л;
Hb2 – уровень гемоглобина у пациента в г/л;
D – расчетная величина депо железа для массы тела < 35 кг – 15 мг/кг, для массы тела > 35 кг – 500 мг.
Оптимальная суточная доза для препаратов железа при лечении ЖДА должна соответствовать необходимой суточной дозе и рассчитываться по приведенным формулам. Применение меньших доз препаратов не дает адекватного клинического эффекта. При латентном дефиците железа или для насыщения депо после окончания курса терапии применяются половинные относительно лечебных дозы препаратов [9].
Из железосодержащих препаратов особого внимания заслуживают многокомпонентные оральные препараты. Предпочтение данных препаратов обусловлено отсутствием или низкой частотой побочных эффектов, а главное, быстрым увеличением уровня гемоглобина и нормализацией показателей ферростатуса. Положительный эффект объясняется дополнительными компонентами в составе этих препаратов. Оптимальный препарат должен состоять из сульфата железа в достаточном количестве, аскорбиновой кислоты, превышающей в 2–5 раз количество железа в препарате, больших доз фолиевой кислоты и цианокобаламина. Эти компоненты принимают активное участие в процессах метаболизма железа в организме, обеспечивая лучшую абсорбцию этого микроэлемента из ЖКТ.
На сегодняшний день представлен большой выбор ферропрепаратов, различающихся по составу. Препаратом, наиболее удовлетворяющим всем основным требованиям, является Сорбифер.
Форма выпуска препарата в оболочке предотвращает образование желтой каймы на зубах при длительном приеме. Препарат содержит 320 мг сульфата железа (что соответствует100 мг двухвалентного железа) и 60 мг аскорбиновой кислоты (для улучшения всасывания и усвоения микроэлемента). Мы использовали схему приема препарата – 1 таблетка 2 р./сут. Основными достоинствами препарата являются наименьшая частота побочных эффектов, быстрое купирование объективных и субъективных клинических признаков ЖДА, хорошая переносимость [9, 10]. Эти качества наиболее важны при выборе метода лечения ЖДА у беременных. Дополнительные компоненты препарата обеспечивают лучшую абсорбцию железа и профилактику поливитаминной недостаточности у женщин во время беременности. Результаты исследований доказывают, что Сорбифер оказывает положительное влияние на общее состояние беременной.
Основные схемы лечения препаратом Сорбифер с приемом внутрь после еды: при анемии легкой формы – по 1 таблетке 2 р./сут в течение 3–4-х нед.; при среднетяжелом течении – по 1 таблетке 3 р./сут в течение 8–12 нед., при тяжелой форме – по 2 таблетки 3 р./сут в течение 16 нед. и более. Оценка первых результатов лечения (по уровню гемоглобина) проводится уже через 2 нед. от начала терапии [10].
Таким образом, в настоящее время комбинированный препарат Сорбифер можно считать препаратом выбора при лечении беременных с ЖДА.
Цель исследования: оценка эффективности применения препарата Сорбифер в коррекции ЖДА во время беременности.
Материал и методы
Для реализации поставленной цели были проведены клинико-лабораторное обследование и лечение 33 беременных во II триместре гестации (13–20 нед.) с ЖДА в сочетании с угрозой прерывания различного генеза.
Возраст беременных варьировал от 16 до 39 лет (средний возраст – 27,5±5,6 года).
Результаты анализа свидетельствуют, что характерными для обследованных пациенток явились следующие особенности: высокая частота инфекционных заболеваний, наличие сопутствующей экстрагенитальной патологии, особенно со стороны желудочно-кишечного тракта, хронические очаги инфекции, осложненное течение предыдущих беременностей. ЖДА при предыдущей беременности имела место у 14 (42%) женщин. В обследованной группе первобеременных было 5 (15,1%), первородящих – 9 (27,2%). Из 28 (84%) повторно беременных лишь у 11 (33%) женщин предыдущие беременности закончились срочными родами; у 5 (15,1%) пациенток в анамнезе были самопроизвольные выкидыши и у 3-х женщин (9%) – неразвивающаяся беременность.
Все пациентки предъявляли жалобы на общую слабость, утомляемость, нарушение сна и тянущие боли в низу живота.
Для подтверждения диагноза ЖДА проводилось исследование показателей периферической крови: уровня гемоглобина (Hb), эритроцитов, цветового показателя. Для оценки запасов железа использовано также определение уровня сывороточного железа (Fe) и ферритина (SF). О тяжести течения ЖДА судили по уровню гемоглобина. У 20 беременных имела место легкая степень анемии (снижение уровня гемоглобина от 90 до 110 г/л) и у 13 – средняя степень (снижение уровня гемоглобина от 70 до 89 г/л).
Все беременные, помимо терапии, направленной на пролонгирование беременности (спазмолитики, антиоксиданты, гормоны по показаниям), для лечения анемии получали препарат Сорбифер, который назначали внутрь после еды 3 р./сут в течение 3–4-х нед. при ЖДА легкой степени и в течение 8–10 нед. при ЖДА средней степени тяжести.
До назначения Сорбифера лечение другими железосодержащими препаратами не проводилось. У каждой беременной до и после приема препарата Сорбифер определяли гематологические и феррокинетические параметры.
Результаты и обсуждение
Результаты изучения показателей до и после лечения препаратом представлены в таблице 1.
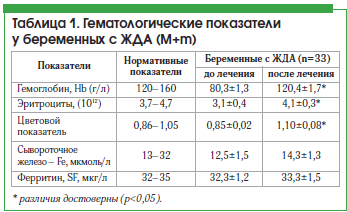
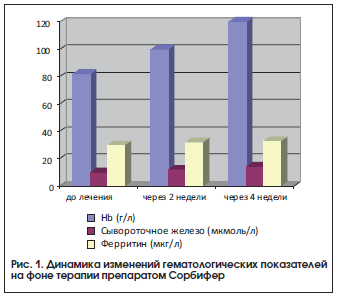
Как видно из приведенных данных, у пациенток после лечения препаратом Сорбифер наблюдались достоверное (р<0,05) увеличение содержания гемоглобина, цветового показателя и уровня эритроцитов, а также увеличение уровня сывороточного железа, хотя разница показателей до и после лечения была недостоверной, что, возможно, связано с наличием легкой степени тяжести ЖДА у большинства пациенток (рис. 1). Нами не выявлено снижение уровня ферритина. Однако, согласно имеющимся данным, содержание сывороточного железа не всегда отражает показатели запасов железа, т. к. оно зависит от скорости высвобождения ферритина из тканей и плазмы [6].

За время наблюдения состояние беременных значительно улучшилось: купировались признаки угрозы прерывания беременности, исчезли жалобы на слабость, утомляемость, нарушение сна. Необходимо также отметить, что за время лечения препаратом Сорбифер побочных эффектов, таких как аллергические реакции, желудочно-кишечные расстройства и др., не наблюдалось.
Таким образом, включение препарата Сорбифер в лечение беременных с ЖДА способствует нормализации показателей периферической крови, улучшению состояния пациенток, а также пролонгированию беременности, что является одним из факторов профилактики невынашивания беременности.
