Гемоглобина как идеального переносчики кислорода

Гемоглобин — железосодержащий дыхательный пигмент крови позвоночных и многих беспозвоночных животных, осуществляющий перенос кислорода от органов дыхания к тканям организма. В крови позвоночных и некоторых беспозвоночных гемоглобин содержится внутри эритроцитов в растворенном состоянии.
Молекула гемоглобина позвоночных животных состоит из белка — глобина и железосодержащей группы — гема. В состав гема входят четыре протопорфириновых кольца, каждое из которых содержит атом двухвалентного железа. Молекулярный вес гемоглобина — 66 000– 68 000. Физиологическая функция гемоглобина как переносчика кислорода основана на его способности обратимо связывать кислород в зависимости от концентрации последнего в крови. В присутствии кислорода железо гема связывает одну молекулу кислорода, при этом гемоглобин превращается в оксигемоглобин. При взаимодействии гемоглобина с окисью углерода (например, при отравлении этим газом) образуется более стабильный комплекс — карбоксигемоглобин.
Продуктами распада гемоглобина являются многочисленные железопорфириновые комплексы. При этом происходит полное отделение гема от белка (хромопротеида); это отделение протекает с превращением железа в трехвалентную форму. Получаемый железопротопорфирин называется гемином, а его соединения — геминодериватами.

Рисунок 2 – Структура гема гемоглобина
Молекула гемоглобина состоит из четырех субъединиц: двух б и двух в – и соответственно содержит четыре полипептидные цепочки двух сортов. Каждая б-цепочка содержит 141, а в-цепочка – 146 аминокислотных остатков. Таким образом, вся молекула гемоглобина включает 574 аминокислоты. Хотя аминокислотные последовательности б- и в-цепочек различны, они имеют практически одинаковые третичные пространственные структуры. Собственно говоря, приведенные выше детали структуры относятся не к гемоглобину, а к его белковой компоненте – глобину. Каждая субъединица гемоглобина содержит одну небелковую (так называемую простетическую) группу – гем. Гем представляет собой комплекс Fe(II) с протопорфирином. Структура гемма представлена на рисунке 2.
Группировка гема представляет собой сложную копланарную циклическую систему, состоящую из центрального атома, который образует координационные связи с четырьмя остатками пиррола, соединенными метановыми мостиками (= СН -). В гемоглобине железо обычно находится в состоянии окисления (2+).
Четыре субъединицы – две б и две в – соединяются в единую структуру таким образом, что б -субъединицы контактируют только с в -субъединицами и наоборот, как показано на рисунке 3.

Рисунок 3 – Схематичное изображение четвертичной структуры гемоглобина: Fe – гем гемоглобина
Как видно из рисунка 3, одна молекула гемоглобина способна переносить 4 молекулы кислорода. И связывание, и освобождение кислорода сопровождается конформационными изменениями структуры б – ив -субъединиц гемоглобина и их взаимного расположения в эпимолекуле. Этот факт свидетельствует о том, что четвертичная структура белка не является абсолютно жесткой.
Атом железа может образовать шесть координационных связей. Четыре связи направлены к атомам азота пиррольных колец, оставшиеся две связи – перпендикулярно к плоскости порфиринового кольца по обе его стороны. Гемы расположены вблизи поверхности белковой глобулы в специальных карманах, образованных складками полипептидных цепочек глобина. Гемоглобин при нормальном функционировании может находиться в одной из трех форм: феррогемоглобин (обычно называемый дезоксигемоглобином или просто гемоглобином), оксигемоглобин и ферригемоглобин (называемый также метгемоглобином). В феррогемоглобине железо находится в закисной форме Fe(II), одна из двух связей, перпендикулярных к плоскости порфиринового кольца, направлена к атому азота гистидинового остатка, а вторая связь свободна. Кроме этого гистидинового остатка, называемого проксимальным (соседним), по другую сторону порфиринового кольца и на большем расстоянии от него находится другой гистидиновый остаток – дистальный гистидин, не связанный непосредственно с атомом железа. Взаимодействие молекулярного кислорода со свободным гемом приводит к необратимому окислению атома железа гемма [Fe(II) > Fe(III); гем > гемин]. В дезоксигемоглобине глобин предохраняет железо от окисления.
Обратимое присоединение кислорода (оксигенация), позволяющее гемоглобину выполнять свою основную функцию переносчика, обеспечивается возможностью образовать прочные пятую и шестую координационные связи и перенести электрон на кислород не от железа (то есть окислить Fe2+), а от имидазольного кольца проксимального гистидина.
Для связывания кислорода с гемоглобином характерна кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. В этом проявляется так называемый аллостерический эффект [15].
Стоит заметить, что лазерное излучение оказывает влияние на процесс оксигенации гемоглобина. Авторы работы [16] измеряли величину насыщения артериальной крови кислородом первой фаланги пальца с помощью высокочувствительного быстродействующего пульсоксиметра. Третью фалангу пальца подвергали облучению He-Ne лазера (20 мВт).
На рисунке 4 представлено изменение величины насыщения артериальной крови кислородом при воздействии лазерного излучением.

Рисунок 4 – Влияние лазерного излучения на насыщение артериальной крови кислородом
На кривой насыщения регистрируются изменения от дыхательных циклов: 40 секунд – начало воздействия, 170 секунд – окончание. Снижение насыщения гемоглобина синхронное с воздействием, демонстрирует дополнительное освобождение кислорода в результате фотодиссоциации гемоглобина. Это не может быть связано с улучшением микроциркуляции. Все происходит слишком быстро и синхронно. Таким образом, это значит, что низкоинтенсивное лазерное облучение высвобождает кислород в месте облучения. Авторы говорят о лазерно-индуцированной оксигенации тканей. Речь идет о селективном повышении локальной концентрации кислорода в тканях. Авторы объясняют этот эффект сдвигом кривой диссоциации оксигемоглобина. И обосновывают это совпадением спектра поглощения гемоглобина и оксигемоглобина с длиной волны He-Ne лазера. То есть, по мнению авторов, оксигемоглобин является акцептором фотона.
Большой интерес для исследователей представляют особенности поведения молекул газов (лигандов) в гемовом кармане гемоглобина и миоглобина. В работе [16] рассмотрены механизмы диффузии лигандов в миоглобине, строение которого очень сходно со строением в-субъединицы молекулы гемоглобина.
Результат расчетов Д. Кейза и М. Карплюса в 1979 году оказался по тем временам несколько неожиданным. Выяснилось, что скорость диффузии лиганда в белке чрезвычайно чувствительна к виду межатомных потенциалов взаимодействия, определяющих конформационную подвижность. Конформационная подвижность обусловлена возможностью вращения молекулярных групп вокруг одинарных С-С-связей [17]. В вакууме при повороте на полный угол преодолеваются обычно три потенциальных барьера высотой ~ 2-4 ккал/моль. В плотноупакованной белковой глобуле эти вращения сильно заторможены из-за стерических препятствий, и, казалось бы, ими можно пренебречь и рассматривать только небольшие колебания атомов около локальных положений равновесия. Расчет динамики связывания лиганда с миоглобином показал, что в этом случае энергия активации диффузии составляет ~ 100т ккал/моль, что примерно в 10 раз больше экспериментальной величины, и процесс при комнатных температурах практически заморожен. Этот результат полностью опроверг представление о белковой глобуле как об апериодическом микрокристаллике. Оказалось, что включение в расчет конформационных степеней свободы совершенно принципиально для белков и снижает энергию активации диффузии лиганда до приемлемого значения ~ 10 ккал/моль. Более того, оказалось, что в структуре миоглобина можно выделить два канала для проникновения лиганда из раствора в гемовый карман. Эти каналы работают с вероятностью около 60 и 40% соответственно и по своей структуре представляют систему флуктуационно открывающихся щелей (дверей), образованных аминокислотными остатками. На рисунке 5 схематически показан путь миграции СО в молекуле гемоглобина из гемового кармана параллельно гемовой плоскости через участок альфа-спирали Е по наиболее эффективному каналу. Молекула СО сначала преодолевает участок между гистидином HisE7 и валином ValEll, а затем между HisE7 и треонином ThrElo с дальнейшим выходом в растворитель.

Рисунок 5 – Схематическое изображение одного из каналов для диффузии лиганда в миоглобине
На рисунке 5 шариком указано место расположения связанного СО в гемовом кармане. Пунктир показывает путь выхода лиганда в растворитель. Плоскость рисунка параллельна гемовой плоскости и находится над ней на расстоянии 3,2 ?. Обозначены положения аминокислотных остатков с указанием спирального участка и номера остатка в спирали (HisE7, ValE11, ThrE10); положение первого аминокислотного остатка в неспирализованном участке, соединяющем спирали С и D (CD1Phe); участок одной из пропионатных боковых цепей, присоединенных к молекуле гемма (3 prop).

Рисунок 6 – Модель диффузии в структурированной среде (белке)
При раскрытии флуктуационной щели на величину х>x0 субстрат 1 может диффундировать сквозь щель. Диффузия субстрата 2 сильно затруднена, так как требуется большая деформация щели (большая энергия активации).
Рисунок 6 иллюстрирует общую схему процесса диффузии через флуктуирующую щель, образованную элементами структуры белковой глобулы. Суть состоит в том, что для акта диффузии необходимо, чтобы просвет во флуктуирующей щели был не меньше, чем ванн-дер-ваальсов размер лиганда. Энергия активации диффузии при этом будет определяться соответствующей энергией раскрытия щели. В жидкостях на форму флуктуационной полости или дырки практически не накладывается существенных ограничений. В белковой глобуле это не так. Здесь имеется относительно жесткий упругий каркас, образованный спиральными элементами структуры. Подвижные боковые группы обеспечивают формирование дырки для диффузионного проникновения лиганда. Но форма этой дырки или щели диктуется локальной геометрией белковой структуры. В твердых телах геометрические ограничения еще более жесткие, но в этом случае в отличие от белка нет подвижных боковых групп, обеспечивающих раскрытие щелей с приемлемой энергией активации. Таким образом, белковая глобула представляет собой структурированную среду, в которой подвижная часть похожа на вязкую жидкость, но возможные формы флуктуационных полостей и щелей ограничены упругим каркасом [19]. Проникновение внутрь белковой глобулы молекул (лигандов), геометрия которых не соответствует этим формам, будет сильно затруднено, так как потребует более широкого раскрытия щелей и соответственно значительно большей энергии активации. На этом этапе с точки зрения физики и закладываются основы стереоспецифичности биохимических процессов.
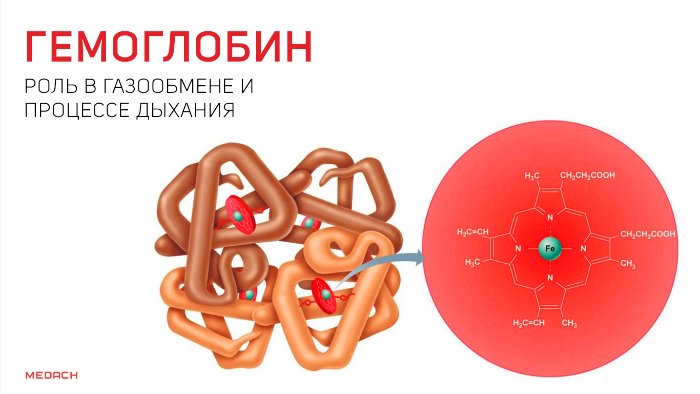
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1–2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
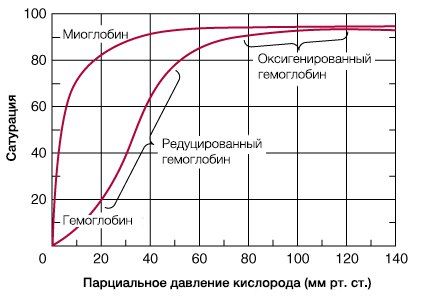
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
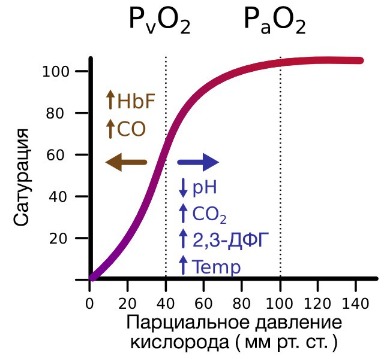
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
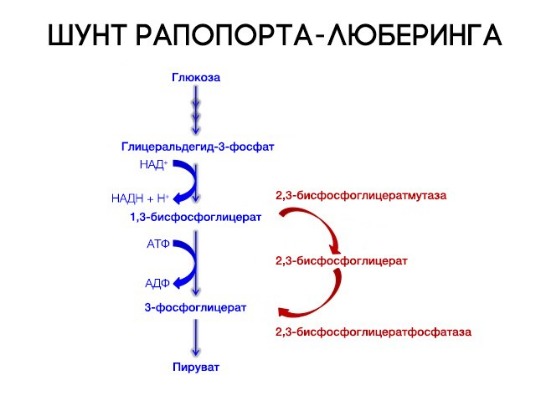
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
