Конформационные изменения субъединиц гемоглобина
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
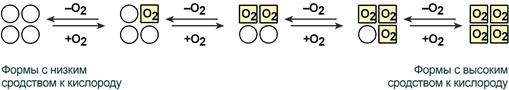
Схема кооперативного взаимодействия субъединиц гемоглобина
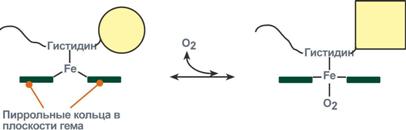
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
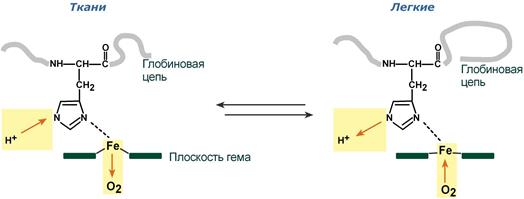
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
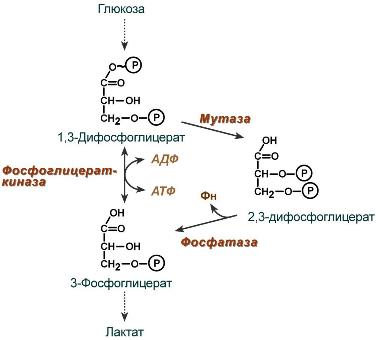
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
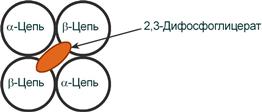
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Два
белка – гемоглобин1
и миоглобин – часто называют дыхательными
ферментами (рис. 1). Оба этих вещества
выполняют роль переносчиков при
дыхании: гемоглобин –
основной компонент красных кровяных
телец2
(эритроцитов), переносящих по артериям
кислород из легких к тканям;миоглобин –
красный белок в мышцах, принимающий
кислород от гемоглобина и хранящий его
таме до того момента, когда он потребуется
для окисления пищевых веществ. Эти
процессы в организме сопряжены с
одновременным переносом углекислого
газа, переправляемого из тканей в легкие,
в основном в виде бикарбоната. Перенос
бикарбоната и углекислого газа идет
также при содействии гемоглобина.
Миоглобин
и гемоглобин представляют собой белки,
соединенные с железосодержащим пигментом
– гемом3
(рис. 2). Белковая часть миоглобина
содержит около 2500 атомов углерода,
азота, кислорода, водорода и серы,
соединенных друг с другом в длинную
цепь, образующую своего рода корзинку
вокруг группы гема. Все 2500 атомов молекулы
миоглобина подчинены единственному
атому железа, расположенному в центре
гема, они обеспечивают обратимое
взаимодействие железа с молекулами
кислорода.
Было
установлено, что гем приобретает
способность переносить кислород лишь
при условии, если его окружает и защищает
специфический белок – глобин (сам по
себе гем не связывает кислород). Обычно
при соединении кислорода с железом один
или более электронов необратимо переходят
с атомов железа на атомы кислорода.
Иными словами, происходит химическая
реакция. Экспериментально было доказано,
что миоглобин и гемоглобин обладают
уникальной способностьюобратимо
связывать O2 без
окисления гемового Fe2+ в Fe3+. Таким
образом, процесс дыхания, который на
первый взгляд кажется столь простым,
на самом деле осуществляется благодаря
взаимодействию многих видов атомов в
гигантских молекулах чрезвычайной
сложности.
Проблемой
молекулярного механизма дыхания, а в
связи с этим выяснением строения
гемоглобина и миоглобина на протяжении
долгого времени занимались английские
ученые М.Перутц и Дж.Кендрю. Взаимодействие
указанных соединений с субстратом –
кислородом – было детально выяснено
прежде всего на основе рентгеноструктурного
анализа высокого разрешения.
Эффект
Вериго-Бора (синонимы —
эффект Вериго, эффект Бора) —
зависимость степени диссоциации оксигемоглобина от
величины парциального
давления углекислоты вальвеолярном
воздухе и
крови, при снижении которого
сродство кислорода к гемоглобину повышается,
что затрудняет переход кислорода из
капилляров в ткани. Эффект этот был
открыт независимо друг от друга Б. Ф. Вериго в
1898 году и датским физиологом Ч.
Бором в
1904.
Важная
особенность анаэробного гликолиза в
эритроцитах по сравнению с другими
клетками – присутствие в них фермента
бисфосфоглицератмутазы. Бисфосфоглицератмутаза
катализирует образование 2,3-бисфосфоглицерата
из 1,3-бисфосфоглицерата (рис. 14-3).
Образующийся только в эритроцитах
2,3-бисфосфоглицерат служит важным
аллостерическим регулятором связывания
кислорода гемоглобином
8.
Ферменты, особенности ферментативного
катализа (механизм выполнения ферментом
каталитической функции, энергетический
барьер реакции, энергия активации,
образование фермент-субстратного
комплекса). Единицы активности ферментов
Ферме́нты,
или энзи́мы
— обычно белковые
молекулы или молекулы
РНК (рибозимы)
или их комплексы, ускоряющие (катализирующие)
химические реакции в живых системах. Реагенты в
реакции, катализируемой ферментами,
называются субстратами,
а получающиеся вещества — продуктами.
Ферменты специфичны к субстратам (АТФаза
катализирует расщепление только АТФ,
а киназа фосфорилазы фосфорилирует только
фосфорилазу).
Ферментативный
катализ (биокатализ),
ускорение биохимических реакций при
участии белковых макромолекул.
называемых ферментами (энзимами).
Ферментативный катализ – разновидность
катализа, хотя термин “ферментация”
(брожение)известен
с давних времен, когда еще не было понятия
химического катализа.
Единицы
активности ферментов.1) За единицу
активности фермента (Uunit, англ.) принимают
такое количество фермента, которое
катализирует превращение 1 мкмоля S (суб
страта) за 1 мин. при оптимальных условиях
(1U= 1 мкмоль/мин.)
2)
В системе СИ активность выражают в
каталах: 1 катал – количество фермента,
катали зирующее превращение 1 моля S за
1 сек. при оптимальных условиях (1кат.=1
моль/с)
3)Удельнаяактивность
определяется количеством единиц
ферментативной активности, которое
приходится на 1 мг белка в биологическом
объекте (U/мг белка)
Соседние файлы в папке экз
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
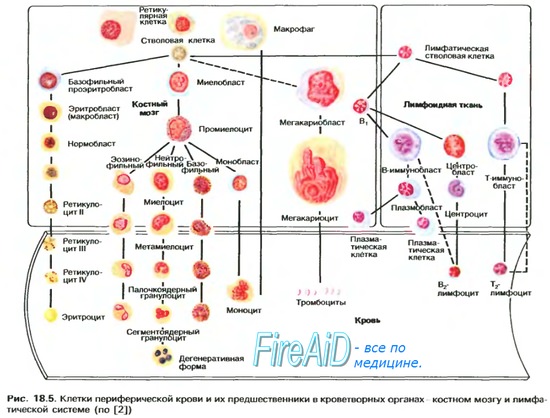
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Кооперативными изменениями конформации протомеров называются изменения конформации всего олигомерного белка после присоединения лиганда к одному из протомеров, приводящее к изменению функциональных свойств белка в целом. Для гемоглобина это означает, что кооперативные изменения конформации его протомеров ускоряют присоединение кислорода в легких и облегчают отщепление кислорода в тканях: – присоединение кислорода через Fe2+ к одному протомеру (оксигенация гемоглобина) вызывает перемещение Fe2+ в плоскость гема; одновременно перемещается и остаток Гис F8, связанный с ним. Это влечет изменение конформации данного протомера, а также остальных субъединиц гемоглобина и их активных центров, то есть вследствии конформационной лабильности изменяется конформация и свойства всего белка;
– измененная конформация белка облегчает связывание второй молекулы кислорода со следующим протомером, что вызывает дополнительные кооперативные изменения конформации протомеров и еще более облегчает связывание со следующей молекулой 02. Четвертая молекула кислорода присоединяется к оставшемуся протомеру в 300 раз легче, чем первая.
– последовательное отщепление кислорода (дезоксигенация) в тканях изменяет на каждом этапе конформацию всех протомеров и облегчает диссоциацию последующих молекул 02.
Кривая диссоциации оксигемоглобина имеет выраженный S-образный характер и отражает положительный кооперативный эффект взаимодействия протомеров (субъединиц) в тетрамер-ной молекуле гемоглобина при его оксигенации.
Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет диссоциация остальных молекул 02; этот процесс зависит от изменения парциального давления 02 в тканях.
Кривая насыщения (диссоциации) миоглобина – простая гипербола, отражает функции миоглобина – обратимое связывание с кислородом, высвобождаемым гемоглобином, депонирование его и освобождение в случае интенсивной физической нагрузки; не зависит от посторонних факторов
Возможность адаптивной регуляции биологической функции олигомерных белков с помощью аллостерических лигандов
Если белок при взаимодействии с лигандом повышает или понижает актив- ность вследствии конформационных изменений, то имеет место аллостериче-ская регуляция, а лиганд называется аллостерическим. Данное свойство проявляется, как правило, у олигомерных белков, т.е. для проявления аллостериче-ского эффекта необходимо взаимодействие субъединиц. При воздействии аллостерических лигандов белки адаптируют свою конформацию (в том числе и активного центра) и функцию к изменившимся условиям окружающей среды.
Для гемоглобина аллостерическими лигандами являются Н+, С02 и 2,3-бифосфоглицерат (БФГ). Эти лиганды присоединяются к участкам (аллостерическим центрам), пространственно удаленным друг от друга. Концентрация аллостерических лигандов влияет на сродство гемоглобина к кислороду (миог-лобин и разделенные субъединицы гемоглобина нечувствительны к изменениям концентрации Н+, СО2 и БФГ, т. е. аллостерические свойства гемоглобина возникают только в результате взаимодействия субъединиц).
В центре молекулы гемоглобина аминокислотными остатками четырех субъединиц образована полость, величина ее увеличивается в дезоксигемогло-бине и уменьшается в оксигемоглобине. БФГ, синтезируемый в эритроцитах при гликолизе, может поместиться только в большой полости дезоксигемоглобина, избирательно связывается с дезоксигемоглобином, снижая его сродство к О2 в 26 раз. В результате повышается высвобождение кислорода в капиллярах ткани при постоянном парциальном давлении О2.
Исследование роли БФГ в транспорте крови прояснило адаптивные механизмы, включающиеся при гипоксии – нарушении снабжения тканей кислородом. У больных с тяжелой обструктивной энфиземой легких затруднено поступление воздуха в легкие, парциальное давление кислорода в артериальной крови (50 мм рт. ст.) вдвое ниже нормы (100 мм рт. ст.). При этом происходит усиление синтеза БФГ в эритроцитах (его концентрация повышается с 4,5 мМ/л до 8 мМ/л), что приводит к увеличению доставки кислорода в ткани. На рис. это отражается компенсаторным сдвигом кривой насыщения гемоглобина кислородом вправо.
Механизм адаптивной регуляции к высоте – также результат изменения концентрации БФГ в эритроцитах крови. На высоте 4,5 км над уровнем моря насыщение крови кислородом снижается из-за снижения парциального давления О2, но уже через два дня возрастает концентрация БФГ в крови с 4,5 мМ/л до 7,0 мМ/л. Сродство к кислороду снижается, и количество высвобождаемого кислорода в капиллярах тканей возрастает. При спуске на уровень моря концентрация БФГ возвращается к исходному уровню.
Date: 2016-05-24; view: 4773; Нарушение авторских прав