Нормы оксигемоглобина в крови

О чем говорят анализы
5. Газы крови
5.1. Кислород
5.2. Двуокись углерода (углекислый газ)
* * *
5.1. Кислород
Важнейшая функция крови — дыхательная. Поглощенный в легких кислород переносится кровью к органам и тканям, а углекислый газ транспортируется в обратном направлении. Основная (ключевая) роль в переносе дыхательных газов принадлежит гемоглобину, содержащемуся в эритроцитах крови.
Гемоглобин относится к классу сложных белков — хромопротеинов. Он состоит из небелковой части, относящейся к железопорфиринам, — гема и белковой части — глобина. Гемоглобин выполняет функцию переносчика кислорода благодаря наличию в молекуле гема двухвалентного железа. Железо гемоглобина, присоединяя молекулу кислорода, не окисляется, то есть не переходит из двух- в трехвалентное состояние, а образует обратимую связь, которая сравнительно легко разрушается при соответствующих изменениях концентрации кислорода в среде.
Гемоглобин (Нb), присоединивший кислород, становится оксигемоглобином (Нb0 2 )
• Реакцию связывания кислорода гемоглобином называют оксигенацией, обратный процесс — дезоксигенацией. Не связанный с кислородом гемоглобин носит название дезоксигемоглобина.
В условиях организма 1 г гемоглобина способен связать 1,34 мл кислорода. Если известно содержание гемоглобина крови, можно рассчитать кислородную емкость крови — максимальное количество кислорода, которое может связать гемоглобин при его полном насыщении 02. При содержании 150 г/л количество кислорода в 1 л крови составит 1,34 х 150 = 201 мл; в 100 мл крови — 20,1 мл или 20,1 об. % (объемных %).
Процентное отношение количества О2, реально связанного с гемоглобином, к кислородной емкости крови называется насыщением (saturation — сатурация) гемоглобина кислородом (SO2 или НBО2). Другими словами, S0 2 — это отношение оксигемоглобина к общему количеству гемоглобина крови.
В норме насыщение артериальной крови кислородом (SO2 или НВО2) составляет 96-98% . Небольшое «недонасыщение» (2-4%) объясняется некоторой неравномерностью легочной вентиляции и незначительной примесью венозной крови, которые имеют место и у здоровых людей.
Насыщение гемоглобина кислородом зависит от напряжения О2 в крови (в соответствии с физическим законом действующих масс). Графически эту зависимость отражает кривая диссоциации оксигемоглобина, имеющая S-образную форму.
Напряжение кислорода в артериальной крови (Ра02) в норме колеблется в пределах 95-100 мм рт. ст. С возрастом газовый состав крови претерпевает некоторые изменения. Напряжение 02 в артериальной крови здоровых молодых людей в среднем составляет 95-100 мм рт. ст.; к 40 годам оно снижается примерно до 80 мм рт. ст., а к 70 годам — до 70 мм рт. ст. Эти изменения связаны с тем, что с возрастом увеличивается неравномерность функционирования различных участков легких.
Таким образом, степень оксигенации крови может быть охарактеризована двумя показателями: напряжением кислорода (РаО2) и насыщением крови кислородом (SO2 или НВО2).
Снижение этих показателей в артериальной крови (венозная кровь для исследования газового состава непригодна) называется артериальной гипоксемией. Умеренная гипоксемия характеризуется прежде всего снижением РаО2, величина S02 (НВО2) более устойчива.
5.2. Двуокись углерода (углекислый газ)
Двуокись углерода — конечный продукт обменно-окислительных процессов в клетках и тканях организма — переносится кровью к легким и удаляется через них во внешнюю среду (99,5% С02 покидает организм через легкие и только незначительная часть выделяется почками).
Двуокись углерода может переноситься как в физически растворенном виде, так и в составе обратимых химических соединений. Химические реакции связывания С02 сложнее и многообразнее, чем реакции присоединения кислорода. Это обусловлено тем, что механизмы, отвечающие за транспорт углекислого газа, должны обеспечивать и постоянство кислотно-основного состояния крови.
Двуокись углерода находится в крови в следующих формах:
• в растворенном виде в плазме — 5%;
• в связи с аминогруппами гемоглобина — 15%;
• в виде угольной кислоты (Н2СО3) — незначительное количество;
• в виде бикарбонатионов (НСО3), обеспечивающих постоянство активной реакции крови (рН), — более 80%.
В нормальных условиях в артериальной крови напряжение С02 (РаС02) составляет около 40 мм рт. ст. (с колебаниями от 35 до 45 мм рт. ст.). Повышение РаС02 называется артериальной гиперкапнией, снижение — артериальной гипокапнией.
Нарушения газового состава крови выявляются при большинстве заболеваний легких. По показателям газового состава артериальной крови можно судить о функции легких в целом.
Идеальным объектом изучения газового состава крови является артериальная кровь, полученная пункцией локтевой или бедренной артерии. Газовый состав венозной крови не может быть использован как показатель функции аппарата внешнего дыхания, так как содержание в ней 0 2 и С0 2 зависит еще и от уровня обмена веществ и скорости кровотока в тканях.
Забор крови и ее доставка к аппарату должны осуществляться без доступа воздуха (в шприце, закрытом капилляре, сосуде под вазелиновым маслом). Шприц и иглу для пункции необходимо промыть гепарином.
Необходимость получения крови из артерии исключает возможность повторных исследований на протяжении короткого периода времени, поэтому широкое распространение получило исследование малых порций капиллярной крови, полученных из кончика пальца или мочки уха.
Еще Холденом было показано, что если руку человека держать в течение 20 мин в водяной бане с температурой воды 38 °С, то в этих условиях газовый состав крови из подкожной вены руки станет идентичным газовому составу артериальной крови. Еще более близок к артериальной газовый состав капиллярной крови.
Используемая в настоящее время измерительная аппаратура предусматривает исследование минимальных порций крови (0,1 мл), которые можно получить из кончика разогретого пальца или мочки уха, предварительно добившись того, чтобы кровоток в ней был максимален (растирание).
Для определения газового состава крови могут быть использованы различные методы.
В настоящее время наиболее доступным и широко распространенным способом изучения оксигенации крови являются оксиметрические методы. Они основаны на различии оптических свойств (спектров поглощения) гемоглобина и оксигемоглобина.
Алый цвет артериальной крови обусловлен тем, что оксигемоглобин достаточно интенсивно поглощает коротковолновые лучи, соответствующие синей части спектра, но пропускает большую часть длинноволновых («красных») лучей. Дезоксигемоглобин более интенсивно поглощает длинноволновые лучи и менее интенсивно — коротковолновые. В связи с этим венозная кровь выглядит темнее и имеет красный цвет с синеватым оттенком.
Для определения насыщения крови кислородом (SO 2 или Нb0 2 ) используются спектрофотометры — приборы, в которых видимый свет при помощи призмы или дифракционной решетки разлагается в спектр. Затем из спектра выделяется узкая полоса лучей с определенной длиной волны (монохроматический свет) и пропускается через исследуемый раствор (порцию крови).
Поглощение света зависит от оптических свойств крови. Для определения соотношения между интенсивностью падающего и прошедшего через раствор света используется фотоэлемент.
Напряжение кислорода и углекислого газа крови можно измерить с помощью специальных электродов.
Для определения напряжения кислорода применяют полярографический метод. Он предусматривает использование двух электродов: измеряющего, изготовленного из благородных (не окисляющихся) металлов (платины или золота), и референтного. Электроды отделены от крови мембраной, проницаемой для газов, и включены в замкнутую цепь, где создается небольшое напряжение.
Молекулы кислорода, диффундирующие через мембрану, восстанавливаются на поверхности измеряющего электрода. В результате возникает электрический ток, величина которого пропорциональна напряжению 0 2 в крови.
Электрод для определения напряжения углекислого газа представляет собой рН-метр, в котором измеряющий и референтный электроды окружены раствором бикарбонатного буфера и отделены от крови тонкой мембраной, проницаемой для газов и непроницаемой для ионов НСО 3 -. Углекислый газ диффундирует из крови через мембрану, вследствие чего меняется рН бикарбонатного буфера. Чем выше напряжение углекислого газа крови, тем большее количество молекул СО 2 проникает через мембрану. Изменения рН электролитного раствора регистрируются амперметром.
Количество оксигемоглобина в крови (выраженное в процентах) определяется двумя факторами: степенью сродства гемоглобина к кислороду и величиной Р02. Зависимость между Р02 и процентом насыщения гемоглобина кислородом выражается кривой диссоциации (КДО), имеющей S-образную форму. Крутой участок кривой располагается между точками 30 и 60 мм рт. ст. по шкале Р02. В этом диапазоне изменения напряжения кислорода на 30 мм рт. ст. приводят к сдвигу насыщения гемоглобина на 60 — 65 %. Изменения в интервале от 60 до 700 мм рт. ст. вызывают повышение или понижение содержания оксигемоглобина на 9-12%.
Насыщение гемоглобина кислородом измеряют при помощи оксигемометров и оксигемографов. Последние снабжены ушными датчиками, точность которых сильно зависит от кровотока в мочке уха. Принцип работы этих приборов основан на том, что оксигемоглобин практически не поглощает свет длиной волны около 600 мкм (т. е. красный). Чем больше в крови оксигемоглобина, тем выше показания прибора. В современных оксигемометрах используют свет двух длин волн — красный (600 мкм) и зеленый (500 мкм). Поток зеленого света одинаково поглощается и окисленным, и восстановленным гемоглобином, и его поглощение зависит только от концентрации гемоглобина и толщины слоя крови в кювете. Это помогает избежать ошибок, связанных с изменениями концентрации гемоглобина. Так действуют геморефлектор МО-1 («Kippund Zonen», Голландия) и оксиметр OSM-1 («Radiometr», Дания); последний рассчитан на работу микрометодом (проба составляет около 100 мкл). В отечественных кюветных оксигемометрах использован отраженный луч красного цвета (600 мкм). Его интенсивность зависит только от содержания в пробе оксигемоглобина, поскольку изменения концентрации гемоглобина в пределах от 6 до 15 г % (60—150 г/л) не влияют на интенсивность потока отраженного света.
В ряде случаев для измерения процента насыщения гемоглобина кислородом применяют номограмму Северингхауза, отражающую кривую диссоциации оксигемоглобина. Номограмма предусматривает коррекцию показателей по рН и температуре исследуемой крови. Этим же целям служит и калькулятор Северингхауза.
Особенности диссоциации оксигемоглобина при высоких и низких значениях Р02 имеют очень большое значение в системе транспорта кислорода: пологий участок КДО обеспечивает относительно нормальное насыщение гемоглобина артериальной крови (около 90 — 94%) даже при уменьшении Ра02 до 70 — 75 мм рт. ст. На крутом участке кривой гемоглобин быстро отдает тканям много кислорода при умеренном снижении Р02.
Способность гемоглобина связывать кислород численно отражает Р50 — парциальное давление кислорода, при котором кровь содержит 50 % оксигемоглобина (условия стандартные рН 7,4; Т = 37 °С). Нормальная величина Р50 — около 26 мм рт. ст. Смещение КДО влево означает увеличение способности гемоглобина связывать кислород (Р50 снижается), и, наоборот, сдвиг кривой вправо говорит об уменьшении сродства гемоглобина к кислороду (Р50 повышается).
Форма и положение КДО по отношению к оси Р02 (а следовательно, и величина Р50) зависят от нескольких факторов, влияющих на степень сродства гемоглобина к кислороду — температуры, концентрации водородных ионов (рН крови) и 2,3-дифосфоглицерата, ионного состава среды, возраста эритроцитов и уровня некоторых гормонов, например, кортизона, альдостерона.
![]()
Между рН, температурой и степенью сродства гемоглобина к кислороду существует вполне определенная зависимость, носящая логарифмический характер: увеличение температуры на 10 °С повышает Р50 на 1,7 мм рт. ст.
Парциальное давление углекислого газа влияет на КДО прямо (вследствие, взаимодействия С02 и карбаминовых групп глобина) и опосредовано (путем изменения концентрации водородных ионов в крови). Любое вещество, обладающее таким свойством, смещает кривую диссоциации оксигемоглобина вправо, и Р50 возрастает (эффект Бора). Сродство гемоглобина к кислороду снижается при повышении ионной силы раствора, концентрации гемоглобина, кортизона, альдостерона. Убедительных данных о специфическом воздействии общих анестетиков на положение кривой диссоциации оксигемоглобина нет.
Содержание 2,3-дифосфоглицерата (2,3-ДФГ) в эритроцитах — очень важный фактор, регулирующий степень сродства гемоглобина к кислороду. 2,3-ДФГ представляет собой один из продуктов гликолиза. Его синтез и распад осуществляются благодаря наличию дифосфоглицератного цикла. Около 20 % 1,3-дифосфоглицерата, образующегося в процессе гликолиза, превращается в этом цикле в 2,3-ДФГ. В физиологических условиях концентрацию 2,3-ДФГ контролируют:
—содержание 2,3-ДФГ как таковое — увеличение его снижает активность 2,3-ДФГ-мутазы, фермента, катализирующего синтез 2,3-ДФГ;
—концентрация водородных ионов — в условиях алкалоза, например, интенсивность гликолиза возрастает, а активность фермента, катализирующего распад 2,3-ДФГ (2,3-ДФГ-фосфатазы), падает;
—концентрация неорганических фосфатов — гипофосфатемия ведет к снижению содержания 2,3-ДФГ в эритроцитах.
Накопление 2,3-ДФГ в эритроцитах происходит и в том случае, если усиление гликолиза вызвано патологическими изменениями (гипоксия, гипертиреоидизм). Блок гликолиза выше фосфоглицератного шунта снижает концентрацию 2,3-ДФГ, а блок на уровне пируваткиназы ведет к значительному накоплению 2,3-ДФГ в эритроцитах.
2,3-ДФГ не диффундирует через мембрану эритроцитов. Увеличение концентрации его вызывает снижение внутриэритроцитарного рН и развитие метаболического ацидоза, поэтому 2,3-ДФГ влияет на положение КДО не только благодаря непосредственному взаимодействию с активными участками цепей гемоглобина, но и путем изменения реакции внутриклеточной среды.
Методы исследования формы и положения кривой диссоциации оксигемоглобина сложны, требуют специальной аппаратуры и определенных навыков; даже незначительные колебания Р50 могут быть весьма показательными. Ниже приводится один из вариантов определения Р50. Пробу крови (10 мл) разделяют на две равные части, одну из которых уравновешивают со смесью газов 02 — 3 %, С02-5,6% N – до 100%, а другую – со смесью газов 02 — 4,5 %, С02 — 5,6 %, N — до 100 %. В каждой пробе измеряют рН, Р02 и Hb02 %. Полученные данные можно нанести на график (по оси абсцисс — Р02, по оси ординат — Нb02 %) для построения прямой или ввести в уравнение Хилла:
![]()
где Y — насыщение гемоглобина кислородом в процентах; К — константа (для ее определения и необходимы экспериментально полученные р02 и Нb02%); « = 2,6-2,7; Р-парциальное давление кислорода.
Вычислив величину К исследуемой пробы крови, уравнение решают при Y= 50.
Графическое построение прямой линии в системе координат Нb02% — Р02 по 3—4 (а тем более 2) точкам не отражает зависимости насыщения гемоглобина кислородом на всем протяжении от 0 до 100 %. В последние годы создан прибор ДСА-1 («Radio-metr», Дания), позволяющий регистрировать КДО в интервале от 0 до 500 мм рт. ст.
Несмотря на то, что исследование кислотно-основного состояния, строго говоря, подразумевает исследование только величины pH (концентрации ионов H+), в реальности в него также включается исследование физиологически важных газов, присутствующих в крови – O2 и CO2. Анализ газов показывает эффективность газообмена по величинам парциальных давлений – pO2 и pCO2.
Через альвеолярную мембрану молекулы любых газов перемещаются диффузно по градиенту концентрации. Молекулы O2 атмосферного воздуха поступают из альвеол в кровь, а молекулы CO2 из крови в альвеолы до тех пор пока их парциальные давления не выровняются.
Величина парциального давления – это процентная доля газа в общем объеме.
Углекислый газ
Концентрация СО2 в альволярном воздухе столь низка, а в крови столь высока, что диффузия этого газа в альвеолы чрезвычайно эффективна и скорость его удаления зависит только от альвеолярной вентиляции – общего объема воздуха, транспортируемого в минуту между альвеолами и атмосферой (“скорости выдувания”).
Следовательно,
- при усиленной вентиляции легких углекислый газ быстро выводится, и показатель pCO2в крови снижается. Это означает потерю организмом угольной кислоты (ионов H+), что является причиной защелачивания крови – алкалоза, называемого дыхательным или респираторным.
- при недостаточной альвеолярной вентиляции величина рСО2 повышается, что свидетельствует о недостаточном его удалении и накоплении H2CO3. Иными словами, повышение в крови показателя рСО2 является причиной дыхательного ацидоза.
Увеличенное pCO2 (гиперкапния) всегда свидетельствует о снижении альвеолярной вентиляции.
Кислород
Вопросы, связанные с оксигенацией крови и транспортом кислорода более сложны. Связано это с тем, что в виде свободных (растворенных) молекул O2 находится лишь небольшая доля общего кислорода крови. Основная часть кислорода связана с гемоглобином (оксигемоглобин) и истинное содержание кислорода зависит от двух дополнительных параметров – концентрации Hb и насыщения (сатурации) гемоглобина кислородом.
Оксигемоглобин
Оксигемоглобин (HbО2) – процентное содержание в крови, является отношением фракции оксигемоглобина (HbО2) к сумме всех фракций (общему гемоглобину).
Насыщение гемоглобина кислородом
Насыщение гемоглобина кислородом (HbOSAT, SО2), представляет собой отношение фракции оксигенированного гемоглобина к тому количеству гемоглобина в крови, который способен транспортировать О2.
Отличия между двумя показателями HbО2 и HbOSAT заключаются в том, что у пациентов возможно наличие в крови такой формы гемоглобина, которая не способна акцептировать О2 (Hb‑CO, metHb, сульфоHb). Но так как большинство больных не имеют в крови повышенного содержания этих форм гемоглобина, значения HbО2 и SО2 обычно очень близки.
Например, если при отравлении нитритами количество metHb составляет 15%, тогда величина HbО2 никогда не сможет превысить 85%, но насыщение (HbOsat) может быть различно – от максимума (HbOsat=95-98%) при полном насыщении до низких величин при отсутствии кислорода.
Показатель насыщения кислородом показывает процент доступных мест связывания на гемоглобине.
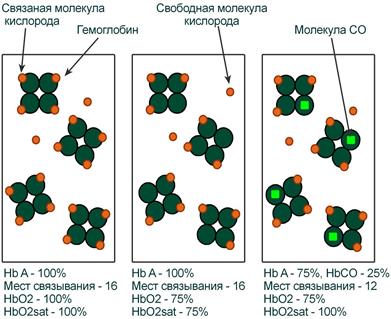
Иллюстрация понятий оксигемоглобина (HbO2) и насыщения гемоглобина (HbO2sat)
Парциальное давление кислорода (pO2)
Парциальное давление O2 выступает как движущая сила, приводящая к насыщению гемоглобина кислородом. И хотя, как правило, чем выше pO2 тем выше HbOsat, эта зависимость не является линейной.
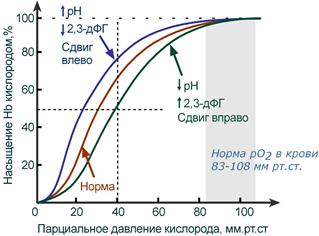
Кривая диссоциации гемоглобина в норме и
при изменении pH и концентрации 2,3-дифосфоглицерата
В центральной части кривой насыщения (или кривой диссоциации) гемоглобина малейшие сдвиги pO2 приводят к резким изменениям насыщения гемоглобина. И наоборот, при высоком pO2 (80-90-100 мм рт.ст) кривая становится плоской, насыщение гемоглобина мало зависит от колебаний кислорода в плазме.
Сдвиг влево происходит при защелачивании и снижении концентрации 2,3-дифосфоглицерата и сигнализирует об увеличении сродства кислорода к гемоглобину (в легких). Сдвиг вправо – это снижение сродства кислорода к гемоглобину (в тканях), обеспечивается закислением среды и накоплением 2,3-дифосфоглицерата.
Показатель pO2 не отражает содержание кислорода в цельной крови! Но хотя pO2 и не показывает общее количество кислорода в крови, но это общее количество зависит от pO2 через показатель сатурации гемоглобина.
В свою очередь имеются факторы, влияющие на величину pO2:
1. Альвеолярная вентиляция. Хотя она влияет как на pO2 так и на pCO2, но доля кислорода в альвеолах при гипервентиляции может лишь слегка увеличиться, приближаясь к pO2 атмосферного воздуха, при гиповентиляции – стремительно падает, вытесняясь поступающим из крови CO2. В то же время доля CO2 в альвеолах быстро снижается при усиленной вентиляции.
2. Вентиляционно-перфузионное соотношение, определяется тем, что
- не вся кровь, притекающая к легким, соприкасается с хорошо вентилируемыми альвеолами (спадение альвеол, уплотнение стенки).
- не все хорошо вентилируемые альвеолы получают достаточно крови (правожелудочковая сердечная недостаточность).
3. Концентрация кислорода во вдыхаемом воздухе (FiO2, fraction of inspired oxygen).
В таблице приведены сравнительные величины концентрации кислорода и углекислого газа в воздухе, крови и тканях.
Необходимо обратить внимание на перепады концентраций кислорода и углекислого газа в крови и альвеолярном воздухе. Важной особенностью является то, что pO2 в альвеолярном воздухе и артериальной крови очень близки, т.е. в обычных условиях глубоким и/или частым дыханием невозможно повысить потребление кислорода и насыщение им гемоглобина. В то же время разность концентраций pCO2 в венозной крови и альвеолярном воздухе позволяет эффективно его удалять при частом дыхании.
| pO2, мм рт.ст. | pCO2, мм рт.ст | |
| Вдыхаемый воздух | 159 | 0,23 |
| Альвеолярный воздух | 105-110 | 40 |
| Артериальная кровь | 83-108 | 35-45 |
| Ткани | 10-20 | 50-60 |
| Венозная кровь | 35-49 | 46-51 |
| Выдыхаемый воздух | 116 | 32 |
